新的抗体针对几种神经系统疾病常见的蛋白质结构
一种新的抗体针对一种被认为在阿尔茨海默病、帕金森病和相关疾病中造成最大损害的蛋白质共有的特征,为统一的治疗方法创造了可能。
这是由纽约大学医学院的研究人员领导的一项研究的发现,并于8月29日在网上发表科学报告.
这项新研究是基于几十年的工作,认为关键蛋白质对疾病的贡献-β淀粉样蛋白阿尔茨海默氏症中的tau蛋白,帕金森症中的α -突触核蛋白,以及类似疾病中的朊病毒蛋白疯牛病-是由一种共同结构所主导的特定有毒形式驱动的:在块状蛋白质中存在大量的“β表”。
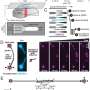
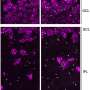
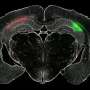
作者说,在这些疾病的尸检患者和活小鼠的组织中,实验证明了该研究的抗体如何仅靶向并清除这些有毒形式,而不会触发迄今为止阻碍治疗开发工作的免疫毒性。
“在过去15年里,无数的治疗方法在临床试验中失败,我们的方法在严格的测试中继续有效,这一事实应该引起同行和行业的兴趣,即使它与传统思维相反,”纽约大学医学院神经病学系研究副教授、通讯作者费尔南多·戈尼博士说。
“虽然在这项工作准备好进行临床测试之前,我们仍有许多里程碑要达到,但我们的结果表明,这些抗体可能会阻止几种神经系统疾病的关键病理机制,无论疾病阶段如何,”通讯作者Thomas Wisniewski医学博士说,他是认知神经学中心主任,西尔伯斯坦阿尔茨海默病研究所和纽约大学阿尔茨海默病中心。
新方法
这项研究的重点是形成大脑重要结构的蛋白质。它们形成链的瞬间氨基酸在美国,蛋白质折叠成复杂的形状来完成它们的工作。不幸的是,蛋白质也可能因为无数的原因(基因异常、毒素、与年龄相关的细胞过程、炎症等)而“错误折叠”,最终导致当前研究中所研究的疾病。随着畸形蛋白质停止工作和积累,细胞和组织会死亡,但该领域一直在努力确定这些转变形式中的哪一种是疾病的关键驱动因素。
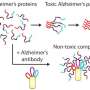
许多研究工作,包括目前的研究,都在寻求设计抗体免疫蛋白它可以附着并移除与疾病相关的目标分子。过去和正在进行的尝试使用的抗体针对氨基酸的初始短链,这些氨基酸是每个错误折叠蛋白质的基本重复结构单位(单体)。还有一些靶向终末期原纤维,每个原纤维由数千个单体组成,聚集在组织无法消除的斑块和缠结中。这两种方法都没有产生有效的治疗效果。
有鉴于此,Goni、Wisniewski和同事们设计了他们的抗体,而不是针对由几个错误折叠的单体结合形成的“低聚物”,并获得“β -薄片”形状,但还没有大到足以纤维化。许多业内人士说,这些中间形式可能具有独特的毒性,因为与原纤维不同,它们可以溶解并进出细胞,从一个细胞移动到另一个细胞。这种移动性可能解释了在错误折叠疾病中看到的“朊病毒样”进展,异常蛋白质导致正常蛋白质错误折叠,形成多米诺骨牌效应,破坏神经细胞及其在大脑中的连接。
重要的是,淀粉样蛋白,tau蛋白,突触核蛋白,还有朊蛋白变得越来越多地被扭曲的氨基酸链所支配,这种β表的空间安排让氨基酸链堆叠起来。
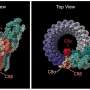
为了设计新型抗体,研究小组将注意力集中在一种由13个氨基酸组成的小肽上,这种小肽来自一种极其罕见的遗传疾病——英国淀粉样变性,但在其他人群中并不存在。他们将其转化为大而稳定的低聚物,具有90%以上的“β -薄片”结构(p13Bri免疫原),现在可以被哺乳动物免疫系统“看到”。它还触发了一种特定的抗体反应,解决了标准方法遇到的问题。通过高剂量的p13Bri免疫小鼠,他们迫使产生极其罕见的抗有毒寡聚物β表的抗体。
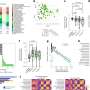
研究人员说,他们的罕见抗体是由一种罕见疾病中才出现的蛋白质片段激活的,对具有相似序列的正常蛋白质引发不必要的免疫反应(自毒性)的几率几乎为零,这是之前许多尝试的失败。最后,研究小组筛选了他们针对阿尔茨海默氏症、帕金森症和朊病毒疾病患者大脑组织的先导抗体。只有6个单克隆抗体对来自两种疾病的至少两个错误折叠蛋白的有毒低聚物有反应,被选作进一步研究。
该出版物详细介绍了第一个系统的制作抗体真正针对的是几种疾病中以β表为主的错误折叠蛋白的有毒低聚物,而不考虑每种错误折叠蛋白的氨基酸组成蛋白质’的单体,”Goni说。