Braf激酶失活突变体诱导肺腺癌
近一半的人肺腺癌的起始致癌事件仍然未知,这使得选择性靶向治疗的发展复杂化。然而,这些肿瘤含有许多没有明显致癌功能的改变,包括braf失活突变。西班牙国家癌症研究中心(CNIO)的研究人员已经证明,小鼠内源性Braf (D631A)激酶失活亚型的表达,对应于人类Braf (D594A)突变,在体内引发肺腺癌,这表明Braf失活突变是肺癌发生的起始事件。
该论文发表于自然,表明MAPK通路的信号强度不仅是肿瘤发展的关键决定因素,而且还决定了肿瘤的性质癌症-启动细胞和最终产生的肿瘤表型。
RAS-MAPK信号级联作为信号从膜受体传导到细胞核的中心节点。这一途径在相当一部分人类癌症中被异常激活。也有大量证据表明,RAS-MAPK信号通路的升高会导致细胞毒性,这可能是肿瘤发生早期癌症进展的天然屏障。这些发现表明,RAS-MAPK活性的定义阈值对于内稳态和恶性转化都是必需的,但缺乏令人信服的遗传证据。
对不同人类癌症的突变分析最近发现了BRAF的热点之一肺腺癌,其中包括RAS-MAP激酶途径的一个组成部分,导致失活突变主导V600E激活替代,其他肿瘤(如黑色素瘤)的主要致癌形式。然而,braf非活性突变体的贡献肺癌症进展尚不清楚。
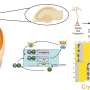
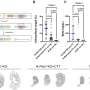
利用公共数据库,研究人员在kras驱动的人类肺肿瘤子集中发现了失活的BRAF突变。随后,利用小鼠模型,研究人员重复了这些观察结果,显示致癌Kras和失活Braf的共表达显著增强了肺的发病腺癌。此外,当失活Braf突变在晚期肿瘤中被遗传诱导时,这种组合加速了肿瘤进展。令人惊讶的是,在同一项研究中,研究人员表明,单独地,Braf的失活突变也是诱发肺腺癌出现的致癌事件。
这篇论文提供了第一个证明激酶失活Braf突变诱导肺腺癌发展的遗传证据。此外,研究结果表明,BRAF低活性的肺腺癌患者可以从基于选择性CRAF抑制剂的治疗中获益。
更多信息:Patricia Nieto等人,Braf激酶失活突变体诱导肺腺癌,自然(2017)。DOI: 10.1038 / nature23297