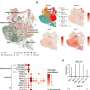
研究了加速药物的证据质量获得FDA的批准

药物中获得加速批准FDA在2009 - 2013年,功效常常被证实在随后的试验中至少3年批准后,与使用非随机研究和替代措施,而非临床结果,是常见的,发表的一项研究显示《美国医学会杂志》。
药物治疗严重或危及生命的条件可以得到美国食品和药物管理局(FDA)加速批准基于显示替代措施的效应,如生物标志物,实验室值,或其他物理措施,只有合理地预测临床效益。然后确认试验要求确定这些影响转化为临床改善。
Huseyin纳希博士M.H.S.,伦敦经济学院的经济学和政治学,伦敦和他的同事们比较了证据资格药物之前和之后获得加速批准,包括验证性研究完成的程度和确定药物证明临床有意义的好处。预批准和确认研究的特点进行对比的研究设计特性(随机化,致盲,比较器,主要终点)。
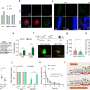
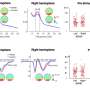
FDA批准加速批准22药物24 2009年和2013年之间的迹象;14 24迹象的这些药物进入市场的基础上single-intervention-group研究了平均的132名患者,一些调查人员会考虑一个小数目。一半的要求确认研究完成至少三年之后市场上批准的药物。
上市后研究的质量和数量要求FDA确认各个适应症临床效益参差不齐。几乎没有统计检测试验的关键设计特性的差异之前和之后进行批准。常见的非随机研究加速批准途径(44%)(60%)之前和之后都进入这一市场。尽管大多数研究显示积极的结果完成上市后时期,所有完成确认研究证明药物效益评估疾病活动而不是替代措施临床结果。临床效益尚未证实八迹象表明,最初被批准之前五年或以上。
研究指出一些限制,包括验证性研究在解决问题的适当药物,FDA认为是未解决的不是因为这样的见解是不可以从FDA检查文档。
更多信息:《美国医学会杂志》(2017)。jamanetwork.com/journals/jama/….1001 / jama.2017.9415