研究人员打开鼠标视网膜细胞的再生潜力
细胞在一个受伤的老鼠眼可以培育成新再生神经元和神经元似乎融入眼睛的电路,新的研究显示。这些发现可能打开门为眼创伤和视网膜疾病的新疗法。这项研究发表在7月26日发行的自然,的部分资金由美国国家眼科研究所(NEI),美国国立卫生研究院的一部分。
“这些发现意义重大,因为他们提出一个新颖的方法鼓励再生的可行性在哺乳动物的视网膜,眼睛的感光组织在后面,死于许多致盲性疾病,”汤姆Greenwell说NEI的博士项目总监。“重要的是,调查也表明,新生成的细胞在小鼠视网膜不仅看起来像神经元,他们也正确地连接到现有的神经回路的眼睛。”
该研究的首席研究员,汤姆盐土,博士和他的团队在西雅图,华盛顿大学医学研究斑马鱼的线索如何鼓励再生在老鼠的眼睛。当斑马鱼伤害眼睛,眼睛内的细胞自然再生,使鱼维持愿景。哺乳动物缺乏这种再生能力。
在研究斑马鱼研究小组关注穆勒神经胶质,一个类型的视网膜细胞支持的健康和功能邻近的神经元,这也表现了天生的再生能力。有时也称为干细胞的斑马鱼,穆勒神经胶质细胞的所有其他类型的视网膜细胞再生的鱼。
早些时候盐土的实验室的研究表明,在新生鼠,穆勒可以直接成为神经胶质视网膜神经元通过激活一个名为Ascl1的转录因子,进而激活一系列基因参与再生。老鼠成年的时候,然而,地区的遗传密码由Ascl1目标和所需的再生成为无法访问。换句话说,在成年老鼠、地区的遗传密码再生关闭业务的关键。
派遣Jorstad和马特Wilken,研究生在盐土的实验室,筛选小分子的图书馆找到了一个可以重新进入成年小鼠的遗传密码。
“我们发现,常用的抗癌剂trichostatin (TSA)关键区域的DNA再次访问。Ascl1可以绑定到这些地区,刺激神经元的再生在成年老鼠,”Jorstad说。
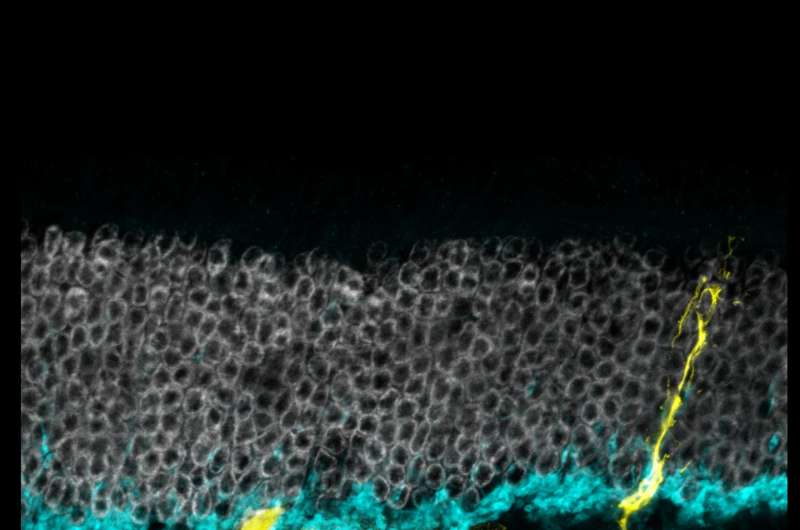
研究人员利用成年小鼠模型转基因表达Ascl1穆勒神经胶质在应对它莫西芬,一种常用的乳腺癌药物。在本设计的鼠标,绿色荧光蛋白(GFP)基因插入Ascl1旁边,以便所有细胞表达Ascl1标记荧光绿。它莫西芬打开Ascl1, GFP追踪Ascl1表达的细胞。
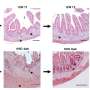
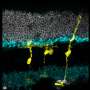
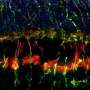
研究人员受伤的小鼠视网膜的毒素,导致细胞死亡视网膜神经节细胞和中间神经元,另一种类型的视网膜细胞的工作就是从光感受器向大脑传递信号。然后他们给老鼠注射TSA和它莫西芬。在接下来的几周,荧光green-labeled细胞的形状和行为观察是否有再生的证据。
观察到的细胞所表达的蛋白质是中间神经元的类似。进一步分析基因组结构的支撑证据表明,穆勒曾经神经胶质细胞基因重组,现在显示中间神经元的特征。
接下来,与电生理学家威廉•格兰姆斯博士和弗莱德里克,威斯康辛大学医学博士学位(格兰姆斯已经搬到马里兰大学学院公园),他们观察细胞的电生理活动在光的存在,利用这一事实穆勒神经胶质回应光不同,衡量模式。大约两周后损伤,细胞对光线,仿佛他们中间神经元。
“我们首次展示,穆勒在成年小鼠神经胶质可以产生新的神经元损伤后,这些神经元基因表达模式,形态学、电生理学,以及表观遗传程序看起来像中间神经元神经胶质,而是“盐土说。
研究细胞形成突触功能——从一个神经元连接到另一个——和对光线的一种中间神经原的典型。细胞还集成了视网膜细胞传递信号到大脑。
“这些发现表明,再生细胞突触和融入双方的电路,presynaptically postsynaptically,“盐土说。
盐土设想这种方法可能是有用的治疗急性眼损伤和视网膜中央动脉阻塞-中风的眼睛。下一步是提高穆勒神经胶质的数字。
“视网膜损伤和视网膜致盲性疾病往往导致大量神经元的损失。我们需要一种方法来刺激穆勒神经胶细胞的再生,除了哄骗他们分化成其他类型的策略神经元”,盐土解释说。
策略也需要再生感光细胞和神经节细胞,还是其他类型的视网膜细胞丢失在青光眼、黄斑变性等退行性眼病。盐土的实验室正在研究其他类型的再生策略来解决所有视网膜细胞类型。
更多信息:尼古拉·l·Jorstad et al,刺激功能从穆勒在成年小鼠神经胶质神经元再生,自然(2017)。DOI: 10.1038 / nature23283