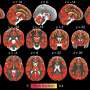
治疗抗氧化剂在帕金森病早期过程可能阻止变性和改善神经功能
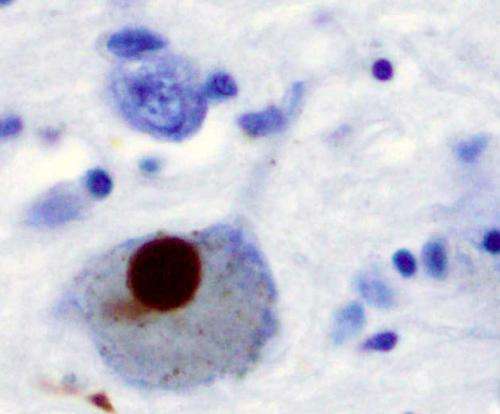
西北医学科学家们已经发现了一种有毒的级联,导致神经元变性患者的帕金森病(PD)和发现如何打断它,9月7日发表的一项研究报告《华尔街日报》科学。
与抗氧化剂在疾病过程的早期干预可能会打破PD的退行性周期和改善神经功能,研究显示。
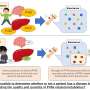
科学家们还发现,帕金森病小鼠模型没有相同的异常在人类PD神经元,他们发现揭示了研究人类神经元开发新疗法的重要性。
迪米特里Krainc博士伦蒙哥马利沃德教授和椅子西北大学Feinberg医学院神经病学研究的资深作者。莉娜Burbulla,博士后Krainc的实验室,是第一作者。
这项研究是大约六年前开始在Krainc马萨诸塞州总医院和哈佛医学院的实验室,并在范伯格在过去四年完成。
帕金森病是第二个最常见的神经退行性疾病,主要是由死亡引起的多巴胺包含在黑质神经元,大脑的一个区域参与运动控制。当人们自然地失去多巴胺神经元随着年龄的增长,PD患者失去更多的这些神经元和剩余的细胞不再能够补偿。
了解如何以及为什么这些神经元死亡是一个重要的步骤在识别治疗,Krainc说。尽管先前的研究表明,细胞死亡背后的细胞机制涉及线粒体和溶酶体,这两个途径如何收敛在多巴胺神经元细胞死亡原因仍不明直到现在。
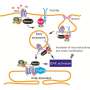
用人类神经元从帕金森病人,Krainc和他的同事们发现了一个有毒的线粒体和溶酶体功能障碍由氧化多巴胺和一种叫做α-突触核蛋白的蛋白质的积累。具体地说,目前的研究表明,氧化多巴胺的积累抑郁溶酶体葡糖脑苷脂酶的活性(GCase),酶与PD。抑郁反过来削弱了整体溶酶体功能和导致神经元变性。
多巴胺的氧化不只是干扰溶酶体,然而。Krainc和他的同事们发现,多巴胺还通过增加线粒体受损神经元的线粒体氧化压力。这些线粒体功能失调导致增加氧化多巴胺的水平,形成一个恶性循环。
“线粒体和溶酶体途径是疾病发展的两个重要途径,“Krainc说,他也是中心主任罕见的神经系统疾病和神经外科手术和生理学教授。“这项研究结合α-突触核蛋白聚集,帕金森病的主要病理特征的链接。”
一旦他们把这个有毒的级联,Krainc和他的同事们开始寻找打断它的方法。
”的一个关键策略,在我们的实验是在有毒的级联的早期治疗多巴胺神经元与特定的抗氧化剂,提高线粒体的氧化压力和降低多巴胺氧化,“Krainc说。“通过这种方法,我们发现我们可以减弱或阻止下游人类多巴胺神经元毒性作用。”
这种方法打断氧化多巴胺的毒性级联可能为未来疗法的发展提供一个目标。然而,识别病人或受试者早期神经退化是困难的,因为损伤经常发生之前任何症状明显,根据Krainc。
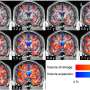
因此,基因测试将将来的诊断工作的核心。诱发基因筛查,而风险基因,如GBA1不确凿,但仍重要的标记,Krainc说。早期检测也将依赖于大脑成像和其他临床特征。
有趣的是,相比人类细胞模型,小鼠模型PD没有展示相同的有毒的级联,根据这项研究。Krainc和他的同事们发现这是由于多巴胺代谢的差异之间的物种,并强调了研究人类的重要性神经元发现新药物开发的目标。
进一步探索