表观遗传学的瘾:表观遗传研究大脑的成瘾和复发的束缚中解放出来
为什么有些吸毒者继续寻找药物的前景,尽管失去家人,朋友,健康或生活吗?
有显著的features-cues-of早期药物环境,习语往往发展成为持久而强大的诱因复发。表观遗传的factors-enzymes大脑改变包装和可访问性的基因不改变基因themselves-influence这个过程,在南卡罗来纳医科大学的研究表明(音乐)出现在线9月27日,2017年神经元。
科学成瘾的主要挑战是了解瞬态经验导致用户长期复发的风险尝试戒烟,根据音乐教授克里斯托弗·w·考恩博士威廉·e·默里SmartState赋予椅子在神经科学,和该项目高级研究员。“我们的目标是发现大脑机制负责药物的有益效果和动机寻求它即使在长时间的禁欲,”科恩说。
的大脑吸毒者人发展到成瘾明显不同于早期或普通用户。持久的关联形式之间的早期使用药物和用药早期环境的不同方面,例如药物首次拍摄的位置或用户的情感体验。这可能会导致上瘾退出用户体验的欲望在一个类似的设置。理解这些连接可能会导致更好的治疗成瘾。
考恩的挑战是确定哪些基因被激活早期用药环境。考恩和他的同事们曾发现表观遗传酶组蛋白脱乙酰酶5 (HDAC5)放缓啮齿动物大脑的形成之间的关联可卡因和简单的环境中的线索,比如光线和声音。HDAC5中发现大量在伏隔核的神经元,大脑的奖励中心的一部分,反应强烈可卡因,阿片类药物和alcohol-both啮齿动物和人类。当hdac核的神经元,它们改变基因组DNA的方式打包在细胞核和经常阻止打开某些基因的能力。
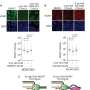
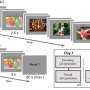
在新的研究中,啮齿动物被训练按杠杆来接收一剂量的可卡因。每次他们收到了一剂,一盏灯在上面杠杆和生成一个简短的声音。这些作为药物使用的简单环境因素。接下来,一些啮齿动物有一种HDAC5直接前往核的神经元。这些啮齿动物仍按操作杆的次数一样多获得药物,这意味着HDAC5,就其本身而言,不太可能是阻断基因促进了早期的毒瘾。
然而接下来的实验证明,在禁欲HDAC5减少毒瘾。模拟撤军和禁欲,啮齿动物有休息没有可卡因一周,紧随其后的是一段在他们再次访问杆。模拟复发,啮齿动物再次显示环境因素,这一次没有按操作杆的。的表示信号触发健壮的杠杆紧迫,表明药物寻求控制动物,证明药物和环境之间的关系保存在他们的大脑。相比之下,动物曾HDAC5没有按杠杆的核形式经常那样,即使实验者给动物一个小启动剂量的可卡因,这往往产生强大的药瘾行为。
HDAC5基因抑制器,并没有阻止addiction-like行为的形成,但它确实防止以后在abstinence-at至少在啮齿动物药物寻求和复发。
下,研究人员利用一种前沿技术,鼓励表观遗传酶与DNA结合,使他们能够识别所有HDAC5基因抑制。NPAS4的基因是一个打击,而且具有一个重要的原因:这是一个早发性基因,也就是说,它可以对大脑的影响迅速,除非HDAC5有抑制其分子事件,考恩和他的团队正在寻求。
在类似的实验中,动物少NPAS4伏隔核中花了更多的时间来形成那些早期的之间的联系环境因素和可卡因,但他们仍然寻求药物一样经常在稍后模拟复发。显然,NPAS4占大脑中的一些集学习和记忆过程,但不是全部,这意味着HDAC5必须调节其他基因,减少复发的事件。考恩认为发现额外的下游基因可以帮助研究人员理清大脑如何转换的细节从早期吸毒上瘾,和如何开发新的治疗方法,以减少复发在个人遭受物质使用障碍。
动物研究设置可能无法充分模仿人类成瘾的复杂性。然而,节制欲望时提醒病人报告药物相关的环境或线索,和动物和人类分享类似的酶途径和大脑结构。成瘾研究也许是最令人兴奋的是,这些过程可能是类似的过渡可卡因、酒精和阿片类药物成瘾。“我们可能有了一个机制关联到多个物质使用障碍,”科恩说。
更多信息:神经元(2017)。DOI: 10.1016 / j.neuron.2017.09.015