研究人员解锁了阿尔茨海默病的分子起源

VCU研究人员发现,即使在分子水平上也可能导致阿尔茨海默病的发育可能导致阿尔茨海默病的发展。
观察叫做大脑中的单体的分子揭示了疾病的途径的有价值的见解。单体类似于每个链接的链是20个氨基酸,基本蛋白的构建块。问题出现问题单体将彼此反复堆叠以形成有害的非典型淀粉样蛋白原纤维,这是长串状结构。
典型的淀粉样蛋白原纤维由含有40个氨基酸链接的单体链制成,并且可以在DNA转录和其他细胞过程中具有作用。全面看看家族(遗传)和老年人(非遗传)阿尔茨海默患者的患者表明,氨基中有两种额外联系的单体酸迈克尔·彼得斯,博士学位,迈克尔·彼得斯(Michael Peters),Ph.D.。
在家族性阿尔茨海默氏症的情况下,单体生产途径中的突变导致较高的单体。它目前未知如何在受老人阿尔茨海默氏症的大脑中发展。
彼得斯表示,它是“非常奇异”,使这两个天然存在的氨基酸在单体的末端添加到单体的末端是如此。
“患有癌症等疾病,您可以沿着链本身具有一个或多个突变或序列变化,从而大大改变了蛋白质的行为,”在阿尔茨海默氏症的情况下,单体中没有突变。你只是加入只有两个天然氨基酸到无毒单体的末端,这导致灾难性。“

命运的捉弄
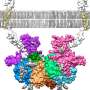
在健康的大脑中,淀粉样蛋白原纤维从彼此顶部的特定序列堆叠中的正常单体构成,类似于建筑物的楼层。这些原纤维堆栈随着它们的构建而削弱,可以分解并“跌倒”。
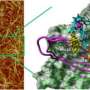
但这不是由Aβ42单体制成的原纤维的情况,这更强大。这些单体继续堆叠而不是破碎,直到它们形成长而有弹性的原纤维。这些原纤维被认为导致阿尔茨海默病的疾病,因为它们侵入了神经元的膜,这导致细胞死亡。
彼得斯和工程学院博士。候选奥斯卡·巴斯蒂达斯进行了计算分析,以确定为什么由Aβ42单体构成的原纤维是如此有弹性。它们确定了两种额外的单体末端氨基酸导致原纤维内特定位置中分子的轻微旋转。这允许单体堆叠在一起,这有助于弹性。
“这是一个字面的命运扭曲,”彼得斯说。
新药
彼得斯和巴斯蒂帕采用这项研究,开发药物以破坏从Aβ42单体构成的原纤维的形成而不伤害大脑。
“我们必须在相当不透水的血脑屏障上获得治疗分子并抑制原纤维形成,同时对身体毒性或干扰正常的身体功能,”彼得斯说。“这使得一个非常艰难的三倍问题,但我们正在取得进步。”
进一步探索













用户评论