帕金森蛋白质和生长因子之间的战争
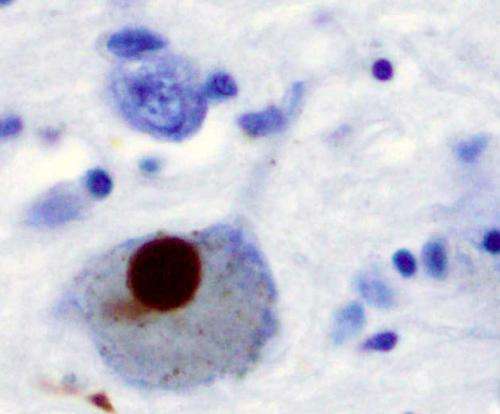
α-突触核蛋白,粘性和有时有毒的蛋白质,涉及帕金森病(Pd),阻止了来自重要脑生长因子的信号,埃里研究人员发现。
结果计划出版pnas.。
该发现增加了证据α-突触核蛋白是PD中脑细胞损伤的枢轴,有助于解释为什么产生的脑细胞神经递质多巴胺更容易变得退化。
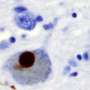
α-突触核蛋白是Lewy体的主要成分,蛋白质团块是Pd的病理迹象。此外,编码α-突触核蛋白的基因中的重复或突变的重复性传递一些稀有的家族性病例。
在目前的论文中,由Keqiang Ye领导的研究人员展示了α-突触核蛋白结合并干扰TRKB,BDNF的受体(脑衍生的神经营养因子)。BDNF促进脑细胞的存活,并已知在帕金森病人的患者中缺乏。当施用于神经元时,BDNF又将α-突触核蛋白远离TRKB发送。
因此,在α-突触核蛋白和BDNF之间存在“拔河”情况,努力在TRKB上努力占据主导地位。在培养的神经元和小鼠中,α-突触核蛋白抑制BDNF的保护能力脑细胞来自与PD相关的损伤有关的神经毒素,叶的团队发现。
以前,认为缺乏过遍的α-突触核蛋白,以扰乱神经元功能的其他方面,例如神经递质合成和重塑突触。科学家提出,“寡聚物”α-突触核蛋白(几种粘合在一起)比单一分子更具毒性。
叶说,仍然未知是否寡头α-突触核蛋白与trkb比单体更强地求核。但是,可以观察到α-突触核蛋白和TRKB之间的相互作用脑患有石油体痴呆患者的样品,其中聚集的α-突触核蛋白是丰富的,但不在对照样品中。
此外,α-突触核蛋白和TRKB之间的相互作用似乎响应了对PD的当前处理。产生多巴胺的神经元对Pd中的变性更敏感,部分原因是多巴胺本身在细胞内部是反应性和潜在的毒性化学品。
在α-突触核蛋白的小鼠中,YE的团队发现多巴胺代谢物的少数,也增强了α-突触核蛋白和TRKB之间的相互作用。[Dopal已提出促进α-突触核蛋白的聚集。然而,抑制杜培的产生的药物rasagiline干扰了α-突触核蛋白/ trkb相互作用。
进一步探索








用户评论