美国监管机构批准第二基因治疗血癌

美国监管机构周三批准了第二个基因治疗血癌,一次性,定制的激进的淋巴瘤治疗的成年人。
美国食品和药物管理局允许的销售治疗从风筝制药。它使用相同的技术,称为CAR-T,作为第一个基因治疗批准在美国8月份,诺华制药治疗儿童白血病。
“在短短几十年中,基因治疗已经从一个有前途的概念到实际解决致命和很大程度上无法治愈的形式的吗癌症,”FDA局长斯科特·戈特利布博士在一份声明中说。
治疗,叫做Yescarta,每个病人将耗资373000美元,根据制药商基科学。风筝成为促进城市的子公司,总部本月基列。
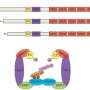
CAR-T治疗不使用基因疗法技术修复致病基因但为提高T细胞,癌症通常可以逃避免疫系统的士兵。T细胞从病人的血液过滤,重组目标和杀死癌细胞,然后种植数以亿计的副本。
回到病人,所有的飞速发展细胞可以继续增加抵抗疾病数月或数年。这就是为什么这些免疫疗法治疗被称为“活的药物。”
“今天的批准Yescarta是一个非常重要的进步淋巴瘤患者和癌症社区作为一个整体,”路易斯·j·德根那罗白血病和淋巴瘤协会的主席,在一份声明中说。“免疫疗法极大地改变了我们的方法的血液癌症治疗。”
风筝的治疗是患者三种类型的咄咄逼人,或快速增长,大b细胞淋巴瘤。最常见的一个约占三分之一的估计每年有72000新病例非霍奇金淋巴瘤的诊断。
Yescarta,也称为axicabtagene ciloleucel,批准的患者已经接受至少两种癌症药物,最终没有为他们工作或停止工作。
在这一点上,病人通常的选择,甚至只有10%的机会暂时缓解他们的癌症,弗雷德里克·洛克博士说,免疫细胞疗法的研究项目主任莫菲特癌症中心在坦帕,佛罗里达。骆家辉帮助病人Yescarta测试运行。
“这真是一个令人兴奋的进步对病人没有希望,”骆家辉说。
Yescarta不是一个良性的治疗,3人死亡后的治疗,可引起严重的副作用。FDA要求风筝做一个长期的安全研究和培训医院迅速找出并处理这些反应。
在关键的考验,Yescarta给101名患者。大约72%的癌症收缩和大约一半在8个月后显示没有任何疾病。
虽然它被称为一次性治疗,因为病人“癌症是目前先进,它返回在一些。治疗仍工作在大多数研究参与者,所以其影响的平均持续时间还不知道。
不同类型的基因治疗在FDA正伺机而动。火花疗法”治疗一种罕见的失明有可能在几个月内批准。它旨在改善视力代替有缺陷的基因需要过程。
其他血液癌症的基因疗法正在测试和科学家认为他们可能工作在几年内实体肿瘤。
©2017美联社。保留所有权利。