研究小组发现,正常细胞中的阻断酶可能会阻止胰腺癌的发生
胰腺癌是一种致命的疾病,平均生存时间不到6个月。只有二十分之一的胰腺癌患者能在确诊后存活五年。原因是癌症的隐蔽性;肿瘤细胞隐藏在身体深处,直到疾病晚期才表现出任何症状,这时癌症几乎无一例外地扩散到其他器官。
宾夕法尼亚大学领导的团队的新发现为未来的治疗提供了一个有希望的目标,甚至有可能根除隐藏得很好的转移癌症病变。当他们在患有这种疾病的小鼠中删除编码这种蛋白质的基因时,这些动物的寿命更长,癌症向其他器官的扩散也减少了。
该研究的资深作者、宾夕法尼亚大学兽医学院生物医学科学系主任艾伦Puré说:“我们认为,通过靶向这种蛋白质,我们会在原发肿瘤中看到巨大的变化,虽然我们确实看到了延迟,但最大的变化是在转移中。”“看起来这种蛋白质可能是一种药物靶点,所以我们希望通过一些额外的后续工作,我们将看到它进入患者体内。”
Puré与宾夕法尼亚大学兽医学院的Albert Lo、Elizabeth L. Buza、Rachel Blomberg、Priya Govindaraju、Diana Avery和James Monslow合作完成了这项工作;台北荣民总医院国立阳明大学医学院李忠品教授;以及台北中央研究院基因组研究中心的Michael Hsiao。
他们的论文发表在临床调查洞察杂志.
为了更清楚地了解癌症生物学并扩大潜在的治疗范围,Puré等研究人员和她的同事们日益扩大了他们的研究重点,从孤立地检查肿瘤细胞,到更全面地了解肿瘤如何与周围组织相互作用。这项对所谓“肿瘤微环境”的研究揭示了包裹肿瘤的看似“正常”的组织,即基质,可以阻碍、允许甚至促进肿瘤的发生肿瘤的生长,这取决于许多因素。
基质有时被称为癌症生长的“土壤”;适当的环境要么允许肿瘤生长,要么阻止它生根。
Puré说:“如果你把一个肿瘤细胞放在正常的基质上,它通常会抑制肿瘤的生长。你需要有一个允许的基质,让肿瘤细胞生长失控,最终转移。”
许多因素决定基质是否允许肿瘤发生,但其中一个已被证明是重要的是组织的密度和硬度。基质一方面可以抑制肿瘤细胞生长,但另一方面,重组、紧密堆积或致密的基质可以促进肿瘤生长,使免疫细胞或药物难以到达肿瘤本身。
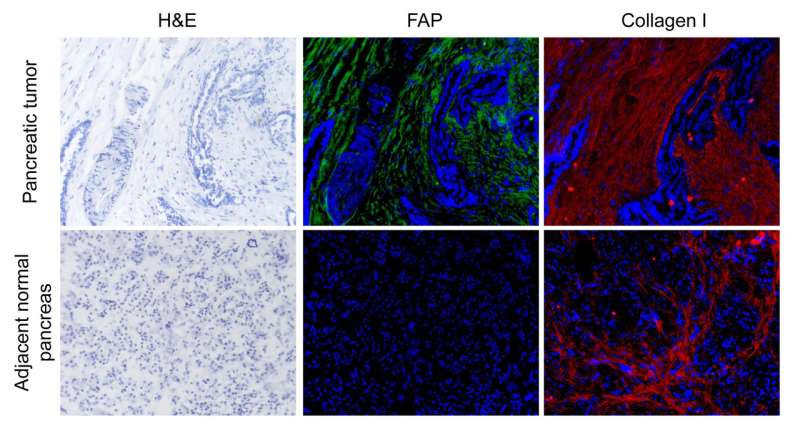
在肿瘤微环境作用的早期研究中,Puré和同事们发现了一种蛋白质,它在形成基质的物理性质中起着作用,这是一种称为FAP的蛋白质切割酶,用于成纤维细胞激活蛋白。在2016年的一篇文章中,研究人员证明,这种酶可以将中等大小的胶原蛋白片段切成可降解的碎片,从而消化胶原蛋白(基质细胞外基质的主要成分)。这种依赖fap的间质翻转促进了肿瘤的生长。当研究小组在肺癌和结肠癌的小鼠模型中删除或抑制FAP时,它会导致基质物质的积累并抑制肿瘤的生长,因为未消化的胶原蛋白抑制了肿瘤并阻止它接受足够的血液供应。
“胶原蛋白是我们必须了解更多的东西肿瘤微环境Puré说。“很多人认为这只是胶原蛋白含量的问题,但我们的研究表明,问题要复杂得多;建筑和结构起着关键作用。”
在目前的研究中,研究人员着眼于胰腺癌肿瘤以结缔组织为主导的类型,看看调节FAP是否可以减少原发肿瘤生长,重要的是,它是否在使其他器官组织更容易发生转移性病变方面发挥了作用。
首先,研究人员观察了人类患者的组织样本,发现FAP水平与预后相关。与FAP水平较低的患者相比,基质细胞中FAP表达水平高的患者的生存时间较短。
在胰腺癌小鼠模型中,取消FAP表达可将疾病发作推迟5周,并将动物的总生存期延长36天。
深入研究FAP是如何影响疾病进程的,研究人员发现FAP缺失的肿瘤有更多坏死的迹象,一种细胞死亡的形式,以及更多的白细胞浸润,这表明FAP通常可能会阻止免疫系统控制肿瘤。
然而,也许FAP更重要的作用是减少癌症从胰腺向其他器官的扩散。
Puré说:“这是我们第一次证明FAP对促进转移很重要。”“通过用药物靶向FAP,我们可能能够通过治疗远端组织来减缓癌症的扩散,你甚至没有意识到它们已经准备好接受了肿瘤细胞这种现象被称为治疗转移前壁龛。这就是我们的希望。”
在未来的工作中,Puré的小组将缩小FAP的哪个方面负责促进疾病进展。目前已经存在抑制其蛋白质切割活性的抑制剂,因此,如果发现这是导致其致癌的原因,那么人类治疗的道路可能是诱人的。
进一步探索