细胞毒性淀粉样原纤维更强
来自阿姆斯特丹和恩斯赫德的研究人员首次对两种与帕金森病有关的淀粉样原纤维进行了结构比较。结合实验方法,他们发现体内丰富的α -突触核蛋白的细胞毒性c端截断形式聚集成更强的扭曲原纤维,这些原纤维更容易暴露在水中。研究结果发表在美国化学学会杂志.
这项研究由博士生Steven Roeters(阿姆斯特丹大学Van 't Hoff分子科学研究所,在Sander Woutersen教授的监督下)和Aditya Iyer (AMOLF,在阿姆斯特丹自由大学Vinod Subramaniam教授的监督下)与特温特大学(UT)的Vladimir Kogan和Mireille Claessens教授合作进行。
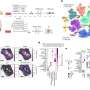
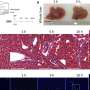
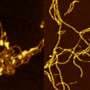
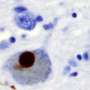
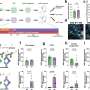
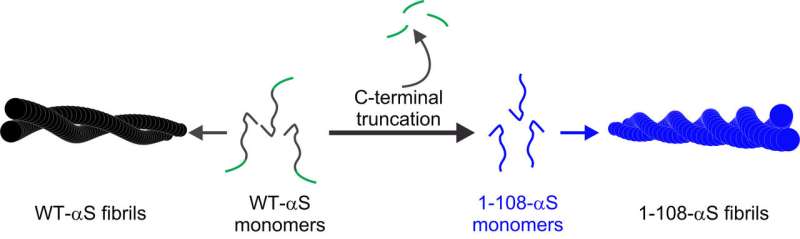
采用多种技术相结合,其中原子力显微镜、紫外圆二色性、x射线衍射和二维红外光谱法,研究人员进行了结构分析,以解释野生型α -突触核蛋白(WT-αS)和所谓的c端截断形式的蛋白质在c端缺乏32个氨基酸(1-108-αS)聚集的差异。最近,其他研究小组观察到后者在体内相当普遍。它更迅速地形成聚集物,并与帕金森病的一种进展形式有关。
研究人员得出结论,由1-108-α s形成的原纤维扭曲程度更强,可能由于扭曲程度更强,它们的原纤维核心更容易暴露在水中。纤维内的氢结合蛋白片之间的距离似乎更大。1-108-αS原纤维和WT-αS原纤维之间的这些差异是如此明显,以至于WT-αS单体不能从1-108-αS短原纤维中生长成原纤维。
通过阐明两种原纤维的关键结构方面,特别是细胞毒性更强的1-108-αS原纤维,研究人员希望提供有助于理解帕金森病和其他相关淀粉样疾病的分子机制的线索。