深入了解鳞状细胞癌背后的分子机制
金泽大学的研究人员报告EMBO报告关于一种新的调节鳞状细胞癌细胞命运的分子机制。鳞状细胞癌(SCC)是一种致命的癌症,起源于皮肤、食道、宫颈和头颈部组织的分层上皮。scc的基因组分析发现,高达30%的肿瘤中有TP63的基因组扩增,在大多数scc中有其mRNA的过表达。
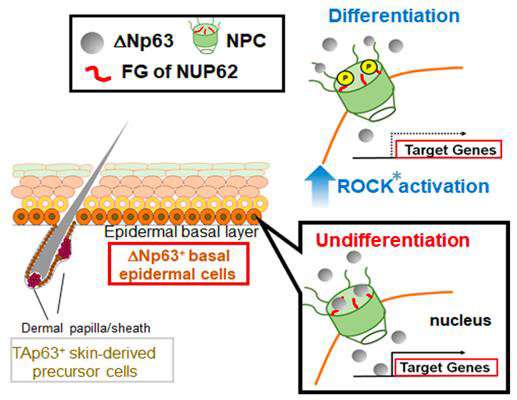
TP63编码的一种蛋白质被称为ΔNp63α,在上皮细胞的发育和维持中起着重要作用。在scc中,ΔNp63α作为不同基因亚群的关键转录调节因子,以维持或增强恶性表型。然而,控制机制核运输到目前为止,我们还不清楚这种蛋白质。
核孔蛋白(NUPs)是一种蛋白质家族核孔复合物(NPC)和调解核运输穿过核膜。最近的证据表明,某些NUPs具有特定细胞类型的功能;然而,NUPs在鳞状细胞癌生物学中的意义仍然未知。
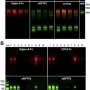
在本研究中,Hazawa等人表明一种特殊的核孔蛋白,核孔蛋白62 (NUP62)在分层鳞状上皮中高度表达,并在鳞状细胞癌中进一步升高。他们进一步证明,NUP62的缺失抑制了SCC细胞的增殖并促进了SCC细胞的分化,这表明NUP62在防止SCC的表皮分化中是必需的。维持无差别状态的能力受损与ΔNp63α核运输的缺陷有关。最后,他们揭示了详细的运输机制,即促分化Rho激酶(一种催化磷酸基团转移的酶)通过减少NUP62和ΔNp63α之间的相互作用来抑制ΔNp63α的核运输。
本研究证明了NUP62通过ΔNp63α核转运调节scc细胞命运的作用。然而,这些NUPs是否在不同组织中(或在其他类型的癌症中)调节细胞身份细胞仍然是一个悬而未决的问题。正如作者在论文中评论的那样:“我们发现NUP62的可转换转运活动突出了这种致癌基因核转运治疗靶向的潜力。”
进一步探索