研究人员发现修复多发性硬化症损伤神经的潜在途径
 CC BY-SA 3.0 Marvin 101/Wikipedia" width="500" height="371">
CC BY-SA 3.0 Marvin 101/Wikipedia" width="500" height="371">
与传统的神经疾病治疗方法相比,在特定细胞和特定区域的基因表达可以提供更精确的神经保护方法。具体来说,对于多发性硬化症,增加脊髓星形胶质细胞中胆固醇合成基因的表达可能是修复影响行走的神经的途径。
多发性硬化症是一种自身免疫、神经退行性疾病,其特征是明显的残疾的人影响行走,视力和认知,举几个例子。多发性硬化症患者在哪些残疾对他们的影响最大方面存在显著差异。炎症会使神经细胞延伸部分(轴突)上的髓磷脂涂层脱落,神经末端的连接(突触)也会丢失,共同破坏信号传递,最终导致永久性残疾,具体取决于发生的位置。
加州大学洛杉矶分校的研究人员提出,每种残疾背后的分子机制可能不同,针对每种残疾量身定制的神经保护治疗可能比旨在减少不同残疾组合的非特异性治疗更有效。研究小组将注意力集中在星形胶质细胞上,星形胶质细胞是一种在多发性硬化症中被激活的脑细胞,在疾病中扮演着几个重要角色表达式在星形胶质细胞的不同区域。
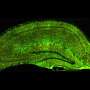
研究小组用患有多发性硬化症的小鼠模型评估了大脑不同区域的星形胶质细胞脊髓已知与行走、视觉或认知有关的。他们比较基因表达变化对应不同残疾的区域之间。在对行走至关重要的脊髓中,他们发现胆固醇合成基因的表达有所下降。胆固醇不会离开血液进入大脑,而是在星形胶质细胞中生成,并在制造髓磷脂(神经涂层)和突触(神经连接)中发挥作用。他们假设,虽然炎症导致髓磷脂和突触的损失,但它是胆固醇合成的减少基因表达他们用一种增加胆固醇合成表达的药物来治疗MS小鼠基因——这就提高了行走能力。
这种针对残疾的发现方法代表了一种针对神经退行性疾病寻找神经保护治疗方法的策略,这种治疗方法针对每种残疾,一次修复一种损伤,与“一刀切”的治疗方法不同。
这项研究发表在美国国家科学院院刊.
除了资深作者Rhonda Voskuhl博士,他指导UCLA多发性硬化症项目,并担任多发性硬化症研究的Jack H. Skirball主席,该研究的共同第一作者是Noriko Itoh, Yuichiro Itoh和Alessia Tassoni,其他共同作者包括Emily Ren, Max Kaito, Ai Ohno, Vista Farkhondeh, Hadley Johnsonbaugh, Yan Ao, Josh Burda和Michael Sofroniew,都来自UCLA。