血管内芯片为新的抗炎药物候选人提供了深入
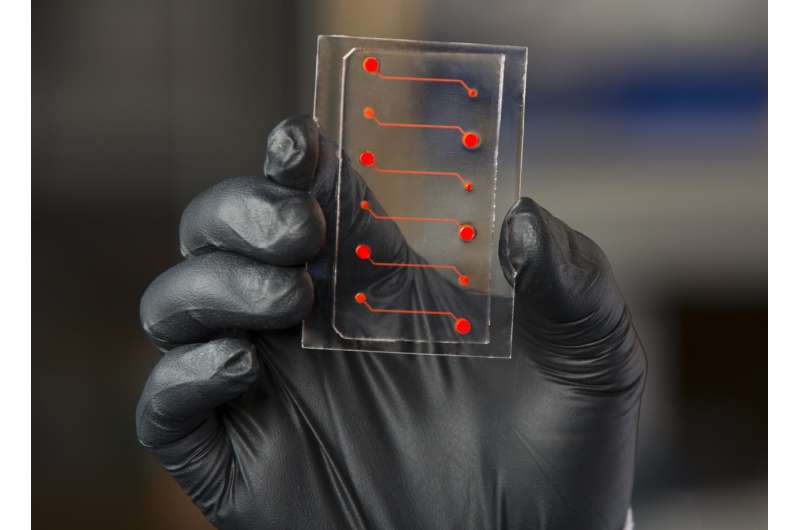
人体中最重要和最有吸引力的过程是炎症。对损伤或疾病的炎症反应对于招募免疫系统来帮助身体愈合至关重要,但炎症也会导致凝血酶的产生增加,这可能导致危险的血液凝块和其他条件。活化的蛋白C(APC)是一种天然存在的抗凝血蛋白,具有抗炎和其他保护作用,其在医学上使用以治疗严重的血液感染和伤口;然而,它的使用是有限的,因为它对血栓凝血酶的抑制也会影响血液的凝块,增加出血风险。
现在,来自Beth Israel Deaconess医学中心(BIDMC)止血与血栓部门和哈佛大学Wyss研究所的研究人员的合作团队发现,合成的被称为“parmodulins”的模拟apc小分子对内皮细胞提供了抗炎和抗血栓保护APC不受干扰血液凝结,让他们有吸引力的新毒品候选人。通过利用该研究所的器官技术来实现这项工作,以在体外血管内模拟凝血。结果在本周的问题中报告国家科学院的诉讼程序。
前Wyss博士后Abhishek Jain博士说:“我们进行了一个小型的临床前试验,研究parmodulins对内皮细胞的影响,不仅确定了parmodulins发挥作用的途径,而且还证明了它们有助于保护内皮细胞免受炎症损伤。”他现在是德州农工大学生物灵感转化微系统实验室的助理教授和主任。
其上APC和Parmodulins作用的靶蛋白是跨膜蛋白蛋白酶活化受体1(PAR1),其存在于血管和血小板通过血液循环的内皮细胞和促进凝血,使机械分析变得困难。PAR1最初鉴定为凝血酶的受体,这是炎症过程的关键部分。然而,当PAR1通过APC对内皮产生时,它触发了抗炎,抗凋亡和障碍途径,所有这些都有助于保护细胞免受炎症的负面影响。
除了激活PAR1之外,APC还能独立抑制凝血酶的生成,而凝血酶是健康血液凝血的重要组成部分——但过度抑制凝血酶会导致不受控制的出血。知道了parmodulins与PAR1结合,科学家和临床医生团队开始寻找一种激活内皮PAR1并在不稀释血液的情况下减少血栓反应的方法,从而提供一个更好的APC替代方案。
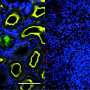
为了评价parmodulins对内皮细胞的活性,本文第一作者,BIDMC博士后研究员Karen De Ceunynck博士,人内皮细胞与parmodulin 2体外孵育4小时,然后暴露于凝血酶诱导炎症剂脂多糖(LPS)或肿瘤坏死因子-α (TNF-α)。在parmodulin暴露的细胞中,与非parmodulin暴露的细胞相比,两种药物产生凝血酶的能力都降低了50%以上。然而,parmodulin 2并没有抑制在凝血过程中起作用的因子V或因子X的活性。De Ceunynck说:“我们对parmodulin 2抑制LPS和tnf介导的内皮表面血栓前效应而不损害血液凝块的想法很感兴趣。”

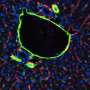
为了确认这一理论,该团队使用了一种伴有嵌入在透明聚合物芯片的微流体通道的血液血管上芯片,涂有胶原蛋白,并排列人类内皮细胞。通过芯片灌注全血以模拟人血管内的流动条件,向其添加不同的促蛋白和抗炎化合物以评估内皮的反应。
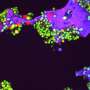
当内皮细胞在全血灌注前暴露于TNF-α时,典型的炎症反应是血小板在内皮细胞上聚集;如果细胞首先暴露于甲摩托蛋白2然后TNF-α,抑制血小板积累,内皮率恢复了其正常功能。这些结果表明,伞菌蛋白暴露阻断了血栓形成响应内皮不影响人体凝血的炎症刺激,这比APC有显著改善。
通过CO-First作者基督徒彼得斯,博士学位进行了一系列测试。在BIDMC,证实甲摩托蛋白2的PAR1激活也诱导细胞保护反应内皮细胞通过通过信号通路抑制由凝血酶,TNF-α和凋亡的生物碱血管孢菌素诱导的细胞凋亡(编程细胞死亡)通过与Parmo的细胞质侧的细胞质侧的特定位点结合的信号传导途径。“我们观察到甲摩托蛋白酶2诱导的细胞保护反应非常迅速地发生,并确认其在时间过程中快速发作和基因表达测定,”彼得斯说。
此外,在小鼠的体内研究表明,伞菌蛋白酶2减少了含义的结合白血细胞至血管在炎症反应期间损伤损伤部位损害血小板和纤维蛋白积聚,证实在体外观察到靶伞菌2的抗血栓形成和抗凝血活性。此外,帕尔莫林蛋白不会与许多APC的其他结合伴侣相互作用,使其更加靶向PAR1并降低其他副作用。
“发现抗炎分子可防止内皮血栓形成,但也保持正常凝血is a major step toward an alternative and better approach to treating inflammatory disease," says Rob Flaumenhaft, M.D., Ph.D., Professor of Medicine at Harvard Medical School, Chief of the Division of Hemostasis and Thrombosis at BIDMC, and corresponding author of the paper. "Furthermore, nearly all other pharmaceuticals that target G-protein coupled receptors like PAR1 bind to the exterior of the receptor; parmodulin 2 represents a paradigm shift for compounds targeting GPCRs because it acts on internal domains. We are excited to see if we can advance it to clinical trials."
"This work provides another example of how organ-on-a-chip technology can enable faster and safer development and evaluation of drugs that could help patients around the world," says co-author and Wyss Institute Founding Director Donald Ingber, M.D., Ph.D., who is also the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as Professor of Bioengineering at Harvard's John A. Paulson School of Engineering and Applied Sciences (SEAS).
进一步探索









用户评论