细胞交通堵塞在ALS / FTD-Supports药物策略
细胞交通堵塞影响神经元出现在大多数形式的ALS(肌萎缩性脊髓侧索硬化症)、埃默里大学医学院和梅奥诊所的研究人员,杰克逊维尔显示。
结果定于出版自然神经科学。
肌萎缩性侧索硬化症研究已经确定了核交通问题最常见的神经退行性疾病的遗传形式,由C9orf72基因突变引起的。只是少数的ALS情况下可以归咎于遗传突变;大多数都是零星的,认为来自遗传和环境因素的结合。研究结果表明,药物策略旨在缓解交通堵塞可能适用于零星的,至少一些家族类型的肌萎缩性侧索硬化症。
项目始于叫做TDP-43的蛋白质的一个调查,一个“坏”的演员在ALS和FTD (额颞叶痴呆)说,资深作者右舵Rossoll博士此前埃默里大学的神经科学助理教授,现在在杰克逊维尔的梅奥诊所。
TDP-43运输被认为是一个“受害者”缺陷C9orf72 ALS, Rossoll说。TDP-43通常是在细胞核中找到。在ALS-affected神经元,截短形式的TDP-43聚集成块,发现在细胞质中。
“我们表明TDP-43也是一个“罪犯”,它会导致运输缺陷在大多数ALS的情况下,TDP-43病理学和其他潜在的神经退行性疾病,如额颞叶痴呆,”他说。
Rossoll和他的团队想找出TDP-43聚集在神经元造成损害。然而,这些聚合物难以分析,因为它们不溶性。科学家们使用一种技术类似于银行试图箔强盗通过加载染料包,准备爆发,在成堆的现金。
张,艾莫利大学的交换生来自中国,一种酶嫁接到TDP-43附近打了一个标签到一切在活细胞。与尼克•塞弗里德博士,生物化学和神经病学助理教授和主任埃默里整合蛋白质组学的核心,张能够分离和识别标记蛋白质。
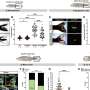
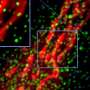
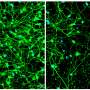
在神经元TDP-43片段聚合,使它们生病,酶标记几个看门人蛋白质、核孔的组件,这是至关重要的移动交通的细胞核。当TDP-43聚合,核孔蛋白。
Ching-Chieh (Ian)周博士前艾莫利大学的研究生,现在在斯坦福大学博士后,是这项研究的第一作者。他发现的形成改变了形状核膜及核孔,从而破坏了蛋白质的导入细胞核和出口的RNA。埃默里/梅奥小组发现在核结构改变皮肤细胞得到ALS患者通过乍得黑尔斯,医学博士,博士,神经病学助理教授,同时C9orf72形式等等。他们看到类似的问题在神经元从患者的诱导干细胞生成. .
在事后ALS患者脑组织中,研究者还可以看到核孔蛋白的聚集。值得注意的是,这些都是可见的在零星的ALS情况下以及那些由突变C9orf72或TDP-43。本研究进行了乔纳森玻璃,医学博士,神经学教授和埃默里ALS中心主任。
“TDP43病理学在ALS约98%的情况下,约50%的FTD情况下,现在我们的工作支持接受结论nucleopore异常不限于C9orf72扩张突变,”格拉斯说。“确认人类大脑中的体外数据组织是非常重要的,使研究结果更加相关。”
他补充说,仍有“先有鸡还是先有蛋”的问题围绕TDP-43聚合和核孔异常。
迫使培养神经元产生aggregation-prone TDP-43碎片是有毒的。但埃默里/梅奥的团队表明,药物,夹了一些核运输路线,可以在文化的毒性作用。药物,称为可耐福天津公司- 335或verdinexor由Karyopharm治疗,抑制核出口。可耐福天津公司- 335可能弥补中断蛋白质进口,并可能防止太多TDP-43积累细胞核外,Rossoll说。药物与可耐福天津公司- 335显示有益C9orf72动物模型的形式的肌萎缩性侧索硬化症,这类药物是临床研究。
进一步探索