心脏细胞通过同时测量收缩力和静止张力来感知硬度
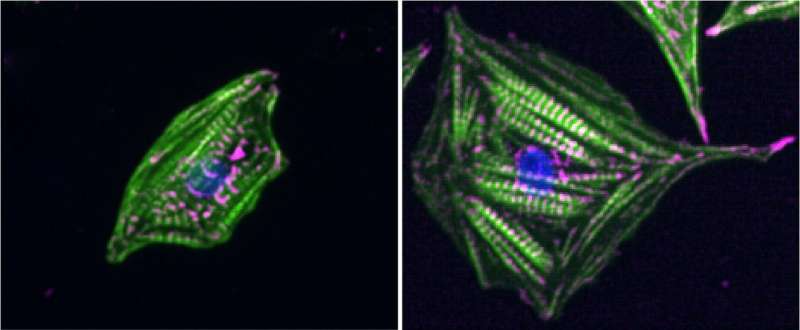
伦敦玛丽女王大学的研究人员发现了一种新的机制,在这种机制中,心脏细胞内的粘附结构通过肌肉收缩和静止张力同时感知僵硬。
这项研究发表在细胞发育,进一步表明静息张力在心细胞的值增加。心脏病以及其他心脏病。这改变了心脏细胞感知刚度因为他们失去了敏感性。
这表明,当静息张力增加时,异常的机械感应和信号传递是心脏进展的一个促成因素疾病对心力衰竭。当细胞误读了周围环境的属性,就会导致心脏细胞不能跳动。
玛丽女王学院工程与材料科学学院的首席作者Thomas Iskratsch博士说:“这项研究发展了我们对疾病机制的理解。研究表明,心脏病发作后心脏的变化在两方面导致了疾病。一方面它改变了心脏的机械性能另一方面它改变了如何心脏细胞对这些属性进行测量和响应。”
细胞环境的硬度可以指导细胞从迁移到分化或细胞死亡的过程。许多器官在发育、衰老或疾病过程中会改变硬度。例如,心脏在胚胎形成时变硬,在各种心脏情况下进一步变硬,主要是由于纤维化。
我们知道,这种硬度的变化会影响动物的表型——或外观和行为心肌细胞以及他们高效击球的能力。然而,到目前为止,还不清楚细胞如何测量刚度。
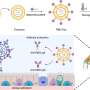
通过确定细胞内黏附结构感知收缩和张力的机制,研究人员发现这种力的组合导致了塔林的拉伸,塔林是黏附细胞内一侧的一种机械敏蛋白。塔林的拉伸会引发一系列的事件,包括加强粘连和向细胞核发送信号以改变细胞表型。
根据环境的硬度,这会导致循环拉伸塔林(当硬度与健康成人心脏相当时)、持续拉伸塔林(当硬度与病变、纤维化心脏相当时),或不拉伸塔林(当硬度与胚胎心脏相当时)。研究人员还发现了更多休息的迹象张力在心脏病,这再次将平衡从循环转移到塔林的连续拉伸。
Iskratsch博士补充说:“还需要进一步的步骤来研究不同类型的talin拉伸是如何转化为改变细胞行为的。此外,还需要更多的实验来观察病变心脏的机械感觉的变化。这将有助于确定新药的靶点。”
进一步探索