常见的帕金森症突变发现背后的机制
西北医学调查人员发现的基因突变导致积累有毒化合物导致帕金森病症状,首次定义的机制方面的疾病。
该研究发表在神经元指出,一个潜在的新的治疗途径使用药物最初打算把另一个条件,高歇氏病,据资深作者约瑟夫•Mazzulli博士,助理教授Ken &露丝Davee神经学部门,部门的运动障碍。
在帕金森氏症,一种叫做α-突触核蛋白转化为不溶性的蛋白质,有毒集群在中枢神经——但是直到现在转换的确切机制尚不清楚。
最强的一个风险因素发展中这些集群是一个突变基因GBA1,通常会降低一个叫做葡糖神经酰胺脂质。一个突变基因会增加患者的葡糖神经酰胺水平和已被证明有5倍为帕金森病风险增加;患者两种突变形式的基因,分别遗传自父母,可以开发高歇氏病溶酶体储存障碍。
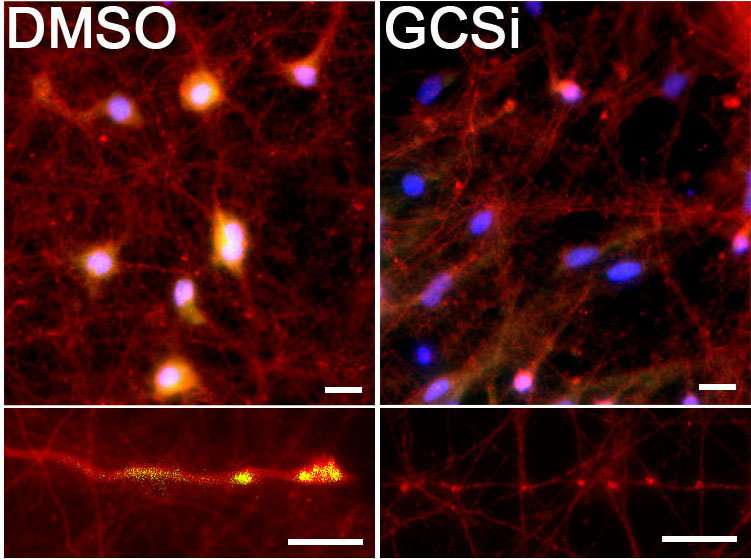
Mazzulli和他的同事们使用这种基因连接阐明GBA1-influenced帕金森病的机制。利用干细胞模型的神经元,他们使用一种药理抑制剂增加葡糖神经酰胺水平没有突变GBA1基因。即使没有突变,这导致了一个戏剧性的积累有毒的α-突触核蛋白的神经元。
“这表明,α-突触核蛋白的范式转换的关键因素,其致病性不一定GBA1突变蛋白的存在,但更重要的是减少活动,积累的葡糖神经酰胺,“Mazzulli说。
与实现,研究人员仔细观察了转换过程,发现α-突触核蛋白的健康形式实际上存在两种不同的形式,一个简单的分子和一个更复杂的分子。时假设之前,只有简单的分子转化为有毒品种,Mazzulli和他的同事们意外发现复杂的分子是由葡糖神经酰胺直接转换成有毒的α-突触核蛋白。
“我们惊奇地发现,有毒聚合发生大的α-突触核蛋白的直接转换复杂,“Mazzulli说。“我们认为复杂的必须先拆卸形成有毒的总量,但这并不是我们的数据显示。”
这些发现表明,未来疗法针对这个途径可能最初利用药物用于治疗高歇氏病,Mazzulli说。尽管制药业一直感兴趣的使用这些lipid-reducing代理一段时间,本研究定义了这些努力背后的分子过程,演示了如何工作。
“一些公司已经使用合酶抑制剂减少脂质合成的,我们用类似的化合物在patient-derived神经元在我们的研究中,“Mazzulli说。“我们能够展示它减少了有毒的α-突触核蛋白聚集直接在神经元来自帕金森患者。”
此外,这项研究给未来的药物试验中一个重要的指标来衡量成功,Mazzulli说。
“我们的终极目标是减少α-突触核蛋白水平的病人,然而测量α-核蛋白的水平从住患者的中枢神经系统是复杂的,”Mazzulli说。“这是更容易衡量的影响改变葡糖神经酰胺的治疗病人,由于脂质可以直接测量方便的液体,如血液或脑脊髓液”。
下一步走向功能治疗将是毕业神经元干细胞动物模型,根据Mazzulli。
“我们试图确定如果这发生在一个有生命的动物,如果我们可以使用类似的化合物的逆转被测试在这些临床试验中,“Mazzulli说。“如果我们能干预之前不溶性淀粉样蛋白的发展,也许我们可以反向正常状态。”