科学家利用基因编辑的类器官开发了一种新的胶质母细胞瘤模型
多形性胶质母细胞瘤(GBM)是一种令人难以置信的致命脑癌,并提出了严重的黑盒挑战。几乎不可能观察到这些肿瘤在自然环境中是如何运作的,动物模型也不总是能提供很好的答案。
但现在,索尔克研究所的研究人员已经朝着迎接这一挑战迈出了重要的一步。通过在人类大脑类器官的几个细胞中编辑两个基因,维尔马实验室的科学家们产生了侵袭性GBM肿瘤。这个新模型可用于研究肿瘤进展,研究新药,甚至为患者提供个性化治疗。这项研究发表在该杂志上细胞的报道2018年4月24日。
困扰临床试验的一个问题是,在动物身上有效的药物通常对人不起作用。研究人员试图通过使用异种移植来克服这一问题,即将患者的肿瘤组织植入动物模型中,但这种方法有其自身的问题。有时,没有足够的人类肿瘤组织来研究,随着时间的推移,肿瘤会适应它们的新家。
“当肿瘤在小鼠体内生长时,环境会改变肿瘤的特征,”索尔克高级研究员、论文第一作者小川纯子(Junko Ogawa)说。“我们不知道它是否与患者原有的癌症相似。”
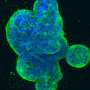
解决方案可能是人类大脑类器官,其中包含神经元和其他脑细胞。一段时间以来,索尔克实验室一直在使用干细胞在培养皿中生成这些小的(约4毫米)3D结构,并希望研究如何将它们应用于GBM的研究。
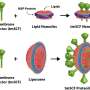
他们使用CRISPR-Cas9工具编辑两个与癌症密切相关的基因,HRas和p53,在一个类器官的几个细胞中。HRas是一种癌症致癌基因,它能促进细胞的疯狂生长,而p53是一种肿瘤抑制基因。换句话说,他们把脚从刹车上移开,猛踩油门。
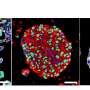
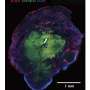
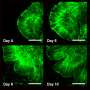
这些类器官在培养皿中变成了肿瘤样结构——它们生长得很凶猛,并具有几种与GBM相关的生物标志物。最终,它们接管了类器官,用肿瘤组织取代了原始细胞。此外,它们可以连续移植到动物模型中,在动物模型中它们也具有相当的攻击性。
这种方法提供了许多优点。在少数细胞中编辑p53和HRas,可以更好地复制GBMs在人体内的实际发展过程——它们不是以数千个细胞(像异种移植一样)同时开始,而是以一两个异常细胞开始。
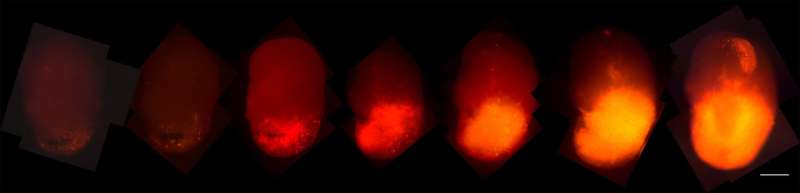
研究小组将一种名为tdTomato的荧光红色标记物添加到致癌HRas中。当这些细胞接管类器官时,研究人员可以追踪它们的进展。此外,当类器官肿瘤被移植到小鼠大脑时,它们迅速生长,与取自患者的肿瘤相似,从而更容易获得样本。
“你可以在老鼠身上复制肿瘤的特性,”小川说,“现在我们可以给它们药物,看看它们是否有效。我们还可以测试肿瘤侵入正常脑组织的能力。”
这些类器官也可以宿主人类肿瘤样本和一些GBM细胞系。这种模式可以用于个性化护理。研究人员和临床医生可以从患者身上移植癌细胞来制作类器官模型。因此,他们可以研究如何肿瘤在与患者基因组匹配的细胞中对治疗做出反应。而类器官缺乏内皮细胞细胞以及免疫系统(这将使它们更加复杂,并帮助它们更好地复制实际的脑组织),这个模型在研究各种脑转移性癌症方面非常有用,而不仅仅是GBM。
进一步探索