研究表明,心肌病突变降低了心脏改变泵送力的能力
华盛顿州立大学的研究人员发现了一种与肥厚性心肌病(HCM)相关的基因突变是如何破坏心脏正常功能的。这项研究将于5月18日发表在《科学》杂志上普通生理学杂志研究表明,当心脏需要向全身泵送更多血液时,这种突变会阻止心脏增加其产生的力量。
根据美国心脏协会的数据,HCM在美国影响了多达50万人,通常是由遗传基因引起的突变这导致心肌变得异常厚实,无法向全身泵入足够的血液。2009年,西班牙的研究人员在心肌蛋白肌钙蛋白T中发现了一种突变,这种突变似乎对儿童和成人造成了特别高的猝死风险,尽管它只导致心肌的轻度增厚心肌墙。这种被称为F87L的突变改变了肌钙蛋白T中心区域的一个氨基酸,但这是如何影响心脏功能的尚不清楚。
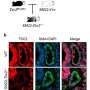
华盛顿州普尔曼的华盛顿州立大学教授Murali Chandra和研究生Sherif Reda在豚鼠的心脏肌钙蛋白T基因中引入了一个等效的突变,并分析了这是如何影响豚鼠心肌纤维收缩和产生力的能力的。
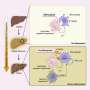
肌钙蛋白T是肌钙蛋白复合物的一部分,它允许肌肉纤维在电刺激释放的钙的作用下收缩。心肌纤维的一个重要特征是,当它们被拉伸到更长的长度时,它们对钙变得更敏感,因此收缩得更强。因此,当心脏充满更多的血液时,就像体力活动增加时发生的那样,它会拉伸肌肉壁,心脏收缩以增加力量泵出额外的血液。肌钙蛋白被认为在这种现象中起着核心作用,这被称为弗兰克-斯特林机制。
Reda和Chandra发现肌钙蛋白T中的F87L突变消除了这种依赖长度的钙敏感性增加。短,未拉伸肌肉纤维表达突变肌钙蛋白T的细胞对钙的反应与较长的拉伸纤维相同。
“我们的数据表明,这种与hcm相关的突变显著降低了长度介导的力量增加,这表明突变可能会钝化肌肉长度介导的心脏力量产生的增加,”钱德拉说。“Frank-Starling机制的衰减可能会对个人产生严重的后果,因为它限制了人们的行为心当它需要向全身泵入更多的血液时,它就有能力增加血液输出。”