阿尔茨海默病:淀粉样蛋白聚集如何改变神经元功能
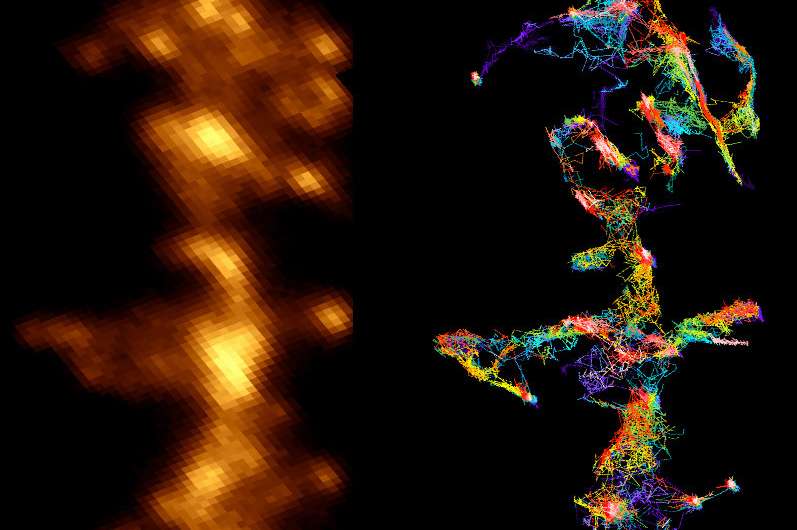
虽然在阿尔茨海默病中观察到的淀粉样肽聚集物的有害影响已经得到了很好的证实,但它们作用于脑细胞的机制仍然不清楚。法国国家科学研究中心和波尔多大学的研究人员刚刚揭示,他们通过与突触可塑性的关键酶相互作用,改变了神经元之间连接的正常功能。研究结果将于2018年6月12日发表在该杂志上细胞的报道.
阿尔茨海默病影响了近100万法国人,其特点是患者的认知能力过早改变,然后是神经变性在后期阶段。这种疾病有三种脑部病变的特征:神经元的损失,纤维变性,以及淀粉样肽的积累淀粉样斑块.这些不同因素在疾病症状发展中的各自作用仍然知之甚少。
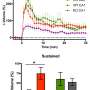
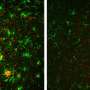
例如,研究人员知道淀粉样肽会破坏突触(神经元之间的接触和化学交流区域),但直到法国神经科学跨学科研究所(CNRS/波尔多大学)的团队进行了研究,才了解它们是如何做到这一点的。他们的发现揭示了在阿尔茨海默病动物模型中观察到的淀粉样蛋白聚集物和缺乏突触功能的分子机制:肽低聚物与突触平衡中的关键酶相互作用,从而阻止其正常动员。
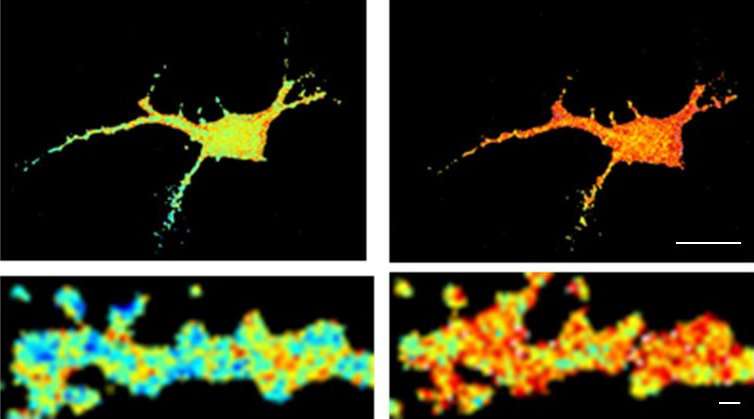
这种分子被称为CamKII,通常负责协调突触可塑性这是神经元适应性的一个方面,使神经元能够加强对它们交换的信号的反应。为记忆信息编码的神经元群由突触连接,突触本身受突触可塑性机制的控制。当两个神经元之间的连接为了记忆信息而必须加强时,例如在强烈刺激时,CamKII被激活,并导致一系列反应,加强它们之间传递信息的能力神经元.突触可塑性是记忆和学习的核心。淀粉样肽阻止CamKII参与突触的可塑性过程,这种阻塞最终导致突触的消失。这一发现可能在阿尔茨海默病的早期阶段得到应用,当时观察到最初的认知缺陷,这可能与突触功能障碍有关。
研究人员现在的目标是继续研究淀粉样蛋白聚集物,特别是通过试图阻止它们与CamKII的相互作用以及在疾病期间观察到的突触损失。