研究人员报告了调节体温的机制
金泽大学的研究人员在神经科学杂志在对小鼠进行的微透析研究中,确定与发烧相关的大脑炎症反应的机制。他们的发现可能被用于开发新的治疗策略。
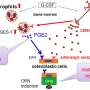
发病的时候发热与下丘脑中一种叫做前列腺素E2 (PGE2)的脂类化合物的释放有关,这种化合物在调节体温方面起着重要作用。然而,PGE2释放的机制以及膜转运蛋白(尤其是由SLCO2A1基因编码的前列腺素转运蛋白OATP2A1)在这一过程中的作用尚不清楚。
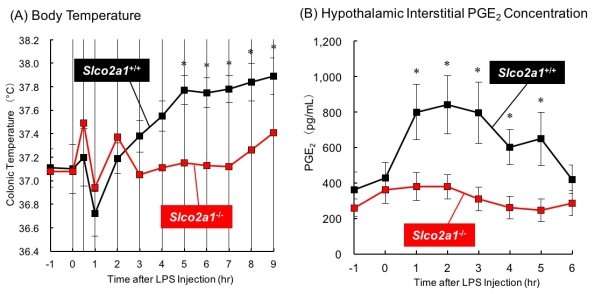
为了阐明这个问题,日本金泽大学的Takeo Nakanishi及其同事在小鼠身上进行了一项微透析研究。研究人员使用了Slco2a1正常的小鼠,Slco2a1完全缺乏的小鼠,以及单核细胞/巨噬细胞特异性Slco2a1缺乏的小鼠。他们首先给它们注射生理盐水,观察有SLCO2A1和没有SLCO2A1的小鼠相同的体温,表明OATP2A1的存在不会影响基础体温。然后他们给予脂多糖,这是一种通常引起发烧的热原。含有Slco2a1的小鼠在两小时后出现发烧,而在完全缺乏Slco2a1的小鼠中没有观察到脂多糖的热原效应。他们进一步证明,人的体温老鼠单核细胞/巨噬细胞特异性Slco2a1缺陷部分减弱。有趣的是,将一种OATP2A1抑制剂注射到Slco2a1正常的大鼠的大脑中,可以抑制发热反应——在这种情况下,只是最初的发热反应上升身体温度被观察到。
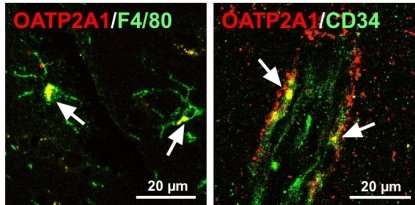
研究表明,发热与下丘脑间质液中PGE2浓度的增加有关,但与脑脊液中PGE2浓度无关,因此OATP2A1似乎是通过刺激下丘脑胶质细胞和脑毛细血管内皮细胞分泌或促进其通过血脑屏障运输来维持下丘脑中PGE2的高水平而起作用的。OATP2A1似乎参与巨噬细胞PGE2的分泌,但在巨噬细胞以外的细胞中,OATP2A1也可能参与发热反应。
这种对潜在机制的新见解炎症反应可能会被用于开发新的治疗策略,这表明OATP2A1是一个有用的治疗靶点。
更多信息:中村吉信等人。前列腺素转运蛋白OATP2A1/ slco2a1对发烧时的体温调节至关重要,神经科学杂志(2018)。DOI: 10.1523 / jneurosci.3276 - 17.2018