发现可以解释阿尔茨海默氏症临床试验失败的原因,并提供解决方案
伦敦国王学院的研究人员发现,阿尔茨海默氏症患者大脑退化背后存在一个恶性反馈循环,这或许可以解释为什么这么多药物试验都失败了。该研究还确定了一种临床批准的药物,可以打破恶性循环,防止阿尔茨海默氏症动物模型的记忆丧失。
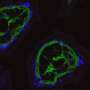
β -淀粉样蛋白的过度生产与阿尔茨海默病的发展密切相关,但许多针对β -淀粉样蛋白的药物在临床试验中都失败了。β -淀粉样蛋白攻击并破坏突触-神经细胞之间的连接大脑-导致记忆问题,痴呆,最终死亡。
这项新研究发表在转化精神病学在美国,研究人员发现,当β -淀粉样蛋白破坏突触时,大脑就会受到影响神经细胞产生更多的-淀粉样蛋白导致更多的突触被破坏。
精神病学、心理学和神经科学研究所(IoPPN)的资深作者理查德·基利克博士说:“我们发现,存在一个恶性的正反馈循环,β -淀粉样蛋白驱动其自身的产生。”“我们认为,一旦这种反馈循环失去控制,针对β -淀粉样蛋白的药物就太晚了,这可以解释为什么有这么多阿尔茨海默氏症。药物临床试验失败了。”
IoPPN的主要作者Christina Elliott博士说:“我们的工作揭示了阿尔茨海默病早期阶段突触丧失和β -淀粉样蛋白之间的密切联系。”“这是我们在了解这种疾病方面向前迈出的重要一步,并强调了早期治疗干预的重要性。”
研究人员还发现,一种名为Dkk1的蛋白质是正反馈回路的核心,它能有力地刺激β -淀粉样蛋白的产生。基利克博士之前的研究和同事们发现Dkk1是阿尔茨海默病的核心参与者,虽然在年轻人的大脑中几乎检测不到Dkk1,但随着我们年龄的增长,它的产量会增加。
研究人员认为,与针对β -淀粉样蛋白本身不同,针对Dkk1可能是一种更好的方法,可以通过破坏β -淀粉样蛋白来阻止阿尔茨海默病的进展恶性循环淀粉样蛋白的产生和突触的丢失。
“重要的是,我们的工作表明,我们可能已经能够阻止反馈回路一种叫做法舒地尔的药物,这种药物已经在日本和中国用于治疗中风。”“我们已经令人信服地证明,法舒地尔可以保护阿尔茨海默氏症动物模型中的突触和记忆,同时减少大脑中β -淀粉样蛋白的数量。”
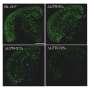
研究人员发现,经过工程改造的老鼠随着年龄的增长,大脑中会产生大量的β -淀粉样蛋白沉积,仅用法舒地尔治疗两周就能显著减少β -淀粉样蛋白沉积。
伦敦国王学院(King’s College London)的研究人员目前正在寻求资金,对早期阿尔茨海默氏症患者进行试验,以确定法舒地尔是否能改善大脑健康,防止认知能力下降。
来自IoPPN的Dag Aarsland教授说:“除了安全药物,法舒地尔似乎以足够的量进入大脑,可能是对抗β -淀粉样蛋白的有效治疗方法。我们现在需要尽快将其推进到早期阿尔茨海默病患者的临床试验。”
进一步探索