2018年10月3日功能
利用畸胎瘤源性成纤维细胞促进成骨
间充质干细胞MSCs是一种很有前途的细胞来源,易于获得并分化为脂肪、骨和软骨等多种中胚层组织再生医学。而在体内植入则需要大量的干细胞和大量的体外细胞培养才能保证成功细胞疗法.因此,将基于细胞的策略从实验室转移到临床的潜力是有限的。在骨研究中,永生成骨细胞系可用于测试新的治疗药物和生物材料作为体外成骨的临床前模型。在骨组织工程,几种策略可以结合起来治疗和恢复大型骨缺损,包括植骨用骨生长因子替代、刺激和适当的祖干细胞引入到诱导骨生成体内。
多能性胚胎干细胞的分化潜力细胞(ESCs)对所有组织类型的影响黄金标准方法畸胎瘤的形成;其中畸胎瘤是一种良性肿瘤,由三层胚层(外胚层、中胚层和内胚层)和无序的混合组织组成。目前还不清楚畸胎瘤源性成纤维细胞(TDFs)是否可以作为一种来源干细胞细胞介导再生医学骨再生.与间充质干细胞相比,TDFs在骨再生方面的主要优势是它们生长迅速,并且在基因功能分析中容易操纵感兴趣的基因。此外,与MSCs相比,TDFs可以大量分离并在体外培养条件下稳定地保持,尽管与MSCs相比,TDFs在体内的临床使用生长情况尚不清楚。
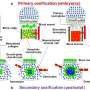
在最近的一项研究中,Yoon Young Go和同事从一个畸胎瘤中分离出成纤维细胞先前建立的协议通过将人类ESCs移植到免疫缺陷小鼠。分离的成纤维细胞能够分化成成骨细胞,其分化潜力与间充质干细胞相似。作者介绍了骨形成蛋白2 (BMP2),一种有效的骨形成生长因子,和单纯疱疹病毒胸苷激酶(HSV-tk)编码基因到TDFs中,以工程一种特殊的,功能TDF细胞系(TDF BMP2/HSV-tk),在体内诱导骨再生。根据设计,在骨生长开始后,暴露于更昔洛韦治疗(GCV;抗病毒药物),由于HSV-tk/更昔洛韦基因标记的存在,TDF细胞发生凋亡消除。这意味着HSV-tk自杀基因可以调节干细胞治疗的副作用,包括不可控的畸胎瘤和肿瘤的形成。研究结果发表在科学报告.

先前的报道表明,在体内刺激骨再生后,TDF人群中出现癌细胞样特征的其他担忧已得到解决没有在小鼠体内重建畸胎瘤重度联合免疫缺陷(SCID)患者。在研究中,工程细胞系显示增强碱性磷酸酶活性(ALP),钙含量升高,成骨基因mRNA表达增加,随后在体内动物模型骨体积形成显著改善。该研究揭示了一种安全、高效的骨再生治疗应用技术。
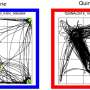
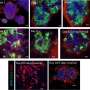
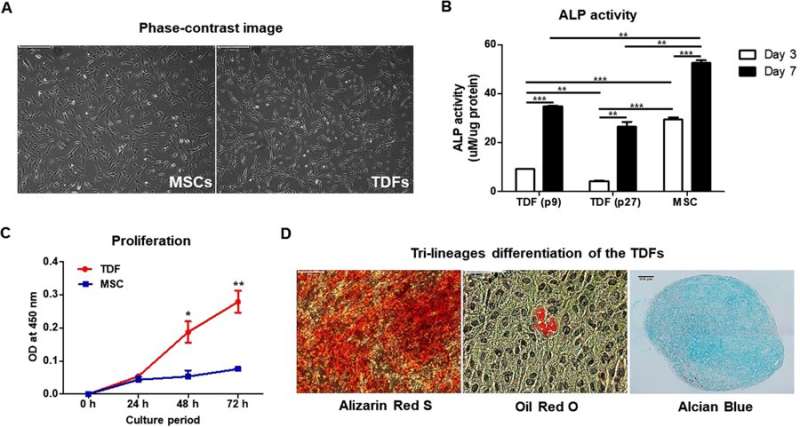
作者初步观察了TDFs和MSCs的形态,随后观察了ALP活性、增殖率和分化率。与TDFs相比,MSCs分化成成骨细胞的能力更强,而增殖试验显示TDF的增长率显著增加。TDFs通过组织学染色来区分成骨、脂肪和软骨形成,同样证实了典型的MSCs三分化。
此外,与不同的人成骨细胞样细胞相比,TDFs表现出更强的成骨分化能力。用亮场成像、碱性磷酸酶活性和钙沉积试验进一步研究了生长培养基(GM)和成骨诱导培养基(OIM)中的功能细胞系。

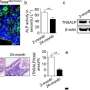
细胞系能够自我产生骨骼生长增加细胞内钙含量和增强成骨分化能力。这是通过成骨标记基因的表达确定的,包括ALPL(骨骼发育和再生),IBSP(骨基质中的结构蛋白),Runx2(骨发育调节剂)和Osterix(SP7,骨特异性转录因子)。在暴露于GCV处理下,工程细胞系发生凋亡,而TDF对照存活。为了确定自身产生的BMP2的成骨能力,工程细胞系与双相磷酸钙(BCP)或聚己内酯(PCL)支架培养在成骨诱导培养基中,并植入动物模型的骨缺损区域(颅骨或胫骨)。在细胞系植入的颅骨缺损模型中,组织学和三维显微计算机断层扫描的综合结果显示新的骨组织三至四周形成。植入后,最佳GCV浓度在500µg/mL时测定,用Laminin/Hoechst染色观察有无处理。

这项研究巧妙地利用了多能干细胞分析的金标准来产生分化成骨组织的畸胎瘤源性成纤维细胞(TDFs)。这样的TDFs可以从患者自身的细胞中设计出来,形成用于移植的患者特异性成骨细胞。作者的最终目的是为骨研究的治疗产生安全、有功能的细胞系。永生成骨细胞细胞系可用于在骨科应用的临床前模型中测试新药。作者将HSV-tk作为自杀基因,以消除工程细胞系的意外癌性增殖,当GCV处理触发时,导致程序性细胞死亡。该细胞系具有巨大的潜力,作为基因匹配患者分化和再生骨的无限细胞源,用于免疫安全的临床转译。
Hoseok Song等。利用基于bac的高效同源重组系统建模人类ESCs中的疾病,细胞干细胞(2010)。DOI: 10.1016 / j.stem.2009.11.016
©2018医学bob游戏快讯