给大脑遥控器增加新的通道
通过对特定细胞的超快速远程控制,光激活蛋白使研究人员能够研究一个大网络中单个神经元的功能——甚至是整个大脑。现在,“光遗传学”的先驱之一和他的同事们创造了两种新的工具——蛋白质孔,当被照亮时,它允许Ca2+进入细胞或K+离开细胞,从而利用光开关神经元。发表在神经科学前沿他们的研究表明,这些合成的“离子通道”可以用来控制特定的神经元,即使是在活体动物身上。
用光控制神经元
格奥尔格·内格尔(Georg Nagel)在Würzburg大学的研究小组将来自各个生命王国的DNA——从水生的嗜热细菌到奶牛——结合起来,创造出在光的作用下打开的混合离子通道。离子通道使神经元等可兴奋细胞产生和运输电信号通过允许带电离子在细胞表面进出。
“通过设计特定的神经元来表达这些通道,我们可以用光来开关它们,”内格尔解释道。
当Nagel和长期合作伙伴Peter Hegemann从绿藻中分离出两个被称为“通道视紫红质”的光激活通道时,光遗传学首次诞生。它们允许带正电荷的离子——特别是Na+离子——进入并刺激神经元。
继通道视紫质之后,另一种天然光遗传离子通道“氟菌紫质”被开发用来作为神经元消音器。光照时,氟菌紫质抑制光诱导的负电荷Cl-离子流入的神经元信号。
由于对更多光基因工具的巨大需求,内格尔和其他人现在使用基因编辑技术来创造具有新特性的合成光激活通道。
“通道视紫红质具有低Ca2+通透性,而像盐视紫红质这样的Cl-通道实际上可以激活Cl-含量高的细胞。尽管合成替代品的数量越来越多,但高渗透性的光敏通道选择性地允许Ca2+进入细胞——或通过释放K+来抑制它们——仍然是许多人的首选。”
设计新的控制开关
构建新的光激活工具,用于Na+/Ca2+和K+的进出细胞,该小组采取了两个现有的离子通道由一种叫做“cAMP”的通用细胞信使分子激活,并将每个分子与一种细菌酶融合,这种细菌酶对光产生反应,产生cAMP。
“我们尝试用不同的方式融合DNA片段,以找到具有最高光激活离子渗透性的配置,”资深研究作者、内格尔protégé高世强博士说。
结果是一个高Ca2+渗透性通道,和一个高渗透性K+选择性通道,每个都被蓝光激活。
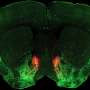
与来自Würzburg大学的丹尼斯·保罗博士、来自莱比锡大学的罗伯特·基特尔教授和纳丁·埃曼博士一起,纳格尔团队开始在果蝇神经元中测试这些新创建的通道,并与来自汉堡ZMNH的克里斯汀·吉博士和博士生Oana Constantin一起在大鼠神经元中测试这些通道。
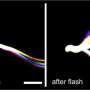
“当被照亮时,这些新通道分别激活或抑制分离的大鼠神经元,”吉博士报告说,“当在整个果蝇幼虫的运动神经元中表达时,会导致身体收缩或放松,”保罗博士补充说。
光遗传学工具包中值得添加的东西
作者强调了在这些通道中使用cAMP调节光响应的潜在缺陷。
cAMP本身在许多细胞过程中是一个重要的信使,因此需要控制只表达细菌cAMP产生酶,以区分光诱导的cAMP、Ca2+和K+的影响。
此外,由细胞内其他酶产生的cAMP可以直接激活通道。这可能解释了为什么被改造表达新通道的果蝇幼虫更小,移动速度略慢,不能成熟为成虫。
尽管如此,Gao和Nagel仍然相信他们最新的贡献是光遗传学工具包的一个有价值的补充,值得进一步的描述和开发。
“总之,我们已经产生了新的和有效的工具,用于光遗传操纵Ca2+或K+的通透性,这为探索复杂神经元系统的功能打开了新的可能性。这些可以应用于成年苍蝇——也许最终也可以应用于哺乳动物——通过发展具有较低cAMP敏感性的突变通道,更好地定位于神经元它们发送和接收电子信号,并诱导表达——例如,通过温度变化启动基因。”