科学家发现了一种新的“看门狗”,可以控制肠道细菌

我们对肠道菌群(生活在人体肠道中的微生物群落)的免疫反应确保这些微生物保持在它们适当的位置。当肠道免疫屏障被破坏时,肠道细菌会扩散并引起全身炎症。现在,国家心血管研究中心(CNIC)和马德里康普顿斯大学免疫学系的研究人员的一项研究揭示了调节这种免疫屏障的新机制。
这项研究发表在该杂志上免疫力,确定了一种机制肠道细菌比如乳酸菌,可以加强肠道屏障,支持互惠关系,预防炎症。该结果对以共生细菌在肠道外传播为特征的疾病的治疗具有潜在意义,例如,在一些代谢疾病中发生。
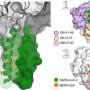
这项研究由CNIC免疫生物学实验室的负责人大卫·桑丘指导。他解释说,这项研究表明,“这些肠道细菌含有或分泌特异性结合受体Mincle (Clec4e)的分子。Mincle表达于先天性免疫系统的抗原呈递细胞树突状细胞表面,其功能是增强肠道屏障。
肠道屏障限制了共生体的定位微生物这样它们就会留在肠道里。这一屏障可被某些疾病和饮食等特定因素削弱,导致与自身免疫和代谢性疾病相关的全身炎症。
研究小组提出了一种新的治疗策略,可以使用益生菌(具有有益特性的肠道微生物)或益生元(促进有益微生物生长的营养物质);然而,这一策略背后的机制目前尚不清楚。
分子机制
很少有人知道分子机制通过共生肠道细菌有助于维持肠道屏障,使它们保持在有益的环境中。桑丘说:“我们的研究表明,共生细菌与受体Mincle的相互作用有助于一种免疫反应这有助于维持肠道中的细菌。这种相互作用可以防止这些细菌扩散到肝脏和其他器官,从而引发炎症和代谢障碍。”
在缺乏Mincle的动物中,“我们观察到能够从肠道逃逸并到达肝脏的细菌数量有所增加,在那里它们引起炎症和代谢变化。”这些发现强调了Mincle作为未来治疗靶点的潜力,旨在加强受损或减弱的肠屏障。
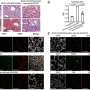
研究表明,缺乏Mincle的小鼠产生细胞因子IL-17和IL-22的肠道淋巴细胞数量减少。研究联合主任萨尔瓦多·伊博拉解释说:“在Mincle存在的情况下,共生细菌促进了这种免疫反应,加强了肠道屏障,从而防止了全身炎症。”
研究小组还观察到肠道障碍通过在小鼠出生后发育早期用共生微生物(如乳酸菌)处理小鼠,增强了小鼠体内的乳酸菌含量。这种效果是通过这些因素的相互作用实现的细菌Mincle在肠内树突状细胞上表达。第一作者María Martínez-López说:“在宿主免疫系统和共生微生物之间发现新的分子通信途径,对于开发治疗互惠关系受到干扰的情况至关重要。”
更多信息:María Martínez-López等人,树突状细胞中Mincle-Syk轴对微生物群的感知调节白细胞介素17和-22的产生并促进肠屏障完整性,免疫力(2019)。DOI: 10.1016 / j.immuni.2018.12.020