胰腺癌新的潜在治疗靶点被发现
癌症细胞需要大量的分子“食物”才能存活和生长自然德克萨斯大学MD安德森癌症中心的研究人员可能已经发现了一种新的方法,可以使最常见和最致命的癌症之一胰腺癌的细胞挨饿。
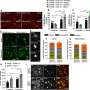
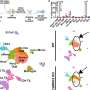
一种最先进的方法,由资深作者Giulio Draetta,医学博士,首席科学官和基因组医学教授开发,被用于跟踪胰腺如何癌症细胞重新排列它们表面的蛋白质。这发现了一种叫做syndecan-1 (SDC1)的蛋白质,它会移动到细胞表面KRAS是一种已知存在于90%以上胰导管腺癌中的蛋白质。
该研究进一步解释了SDC1在细胞表面的定位对胰腺至关重要癌症细胞上调巨量胞饮作用,细胞利用这一机制从环境中清除资源,将其转化为能量或准备它们分裂。
虽然突变KRAS在胰腺癌中激活大细胞增多症的研究由来已久,但控制这一过程的分子机制仍不清楚。Draetta的团队提供了证据,证明SDC1对KRAS的信号做出反应,在细胞表面积累,并诱导这一通路。
Draetta说:“到目前为止,对大细胞增多症的药理抑制还没有完成。”“我们对SDC1在kras驱动的胰腺癌中调节大细胞增多的关键作用的发现,促使我们探索SDC1的靶向治疗干预。”
巨蟹座和“表面生物”
细胞表面或“表面组”是动态的,细胞膜响应细胞和外部环境的信号而移动。在癌症细胞中,基因突变给细胞严格的指令,让它们优先考虑那些支持它们不受控制的生长的途径。
德拉埃塔的团队认为,对KRAS突变如何调整细胞膜功能的详细了解,将揭示胰腺癌细胞赖以生存的途径的关键新细节。
Draetta说:“多种致癌过程在细胞表面启动,KRAS在物理和功能上相互作用,以指导恶性转化和肿瘤维持所必需的信号。”“直到最近,对表面层的复杂性的认识在技术上一直受到限制,在胰腺癌的情况下,KRAS信号背景下胰腺癌表面层的功能和组成的遗传控制在很大程度上仍未被探索。”
由于KRAS突变在胰导管腺癌(一种5年存活率只有8%的毁灭性疾病)中如此频繁,研究人员设计了一种方法来研究胰腺癌模型中的细胞表面,在这个模型中KRAS可以被打开和关闭。
研究人员发现,KRAS表达后,细胞表面的蛋白质发生了显著变化,SDC1是KRAS表达时最丰富的蛋白质之一。这代表了KRAS指令SDC1穿过细胞在细胞表面完成其工作的第一个直接证据。使用不同的方法防止SDC1集成到细胞膜研究人员证实,尽管SDC1可能存在于细胞内部,但它只在被运送到细胞表面时上调了微胞作用。
尽管了解KRAS在维持胰腺癌细胞存活方面的重要性,研究人员在瞄准KRAS方面仍有困难。目前还没有临床可用的药物能充分关闭KRAS信号以杀死癌细胞。了解SDC1在KRAS的控制下为胰腺癌细胞提供能量,可能会使具有这种侵略性突变的肿瘤通过靶向SDC1进行治疗,它在细胞表面的存在可能会使其更容易受到治疗干预。
“我们认为,细胞表面是一个令人兴奋的地方,可以寻找更多关于癌细胞如何从根本上不同于正常细胞的线索细胞,”Draetta说。“已经,单克隆抗体靶向SDC1的药物正被用于多发性骨髓瘤的试验,这一科学步骤可能开启类似疗法的临床研究胰腺癌."