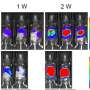
移植骨髓内皮祖细胞延迟ALS疾病进展

移植人类骨骨髓来源的内皮祖细胞(epc)小鼠模仿症状的肌萎缩性脊髓侧索硬化症(ALS)帮助更多运动神经元存活和减缓疾病进展通过修补损坏blood-spinal绳屏障(BSCB),南佛罗里达大学的研究人员报告。
这项新的研究,发表在3月27日科学报告,导致越来越多的工作探索细胞疗法在ALS屏障修复方法和其他神经退行性疾病。
逐步退化的神经细胞控制肌肉运动(运动神经元)最终导致总从ALS瘫痪和死亡。每一天,平均15个美国人被诊断出患有这种疾病,根据ALS协会。
之间的屏障损害血液循环系统和中枢神经系统被认为是一个关键因素ALS的发展。违反这个防护墙打开了大脑和脊髓免疫/炎症细胞和其他潜在有害物质在外周血循环。生化的级联事件导致ALS包括改变他们的内表面的微小血管内皮细胞受损的脊髓运动神经元附近。
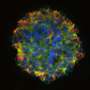
这一最新的研究主要作者Svitlana Garbuzova-Davis,博士和他的同事们在普遍服务基金健康Morsani医学院的卓越中心的老化与大脑修复,建立在之前的一项研究显示,人类骨骨髓来源干细胞改善ALS症状小鼠运动功能和神经系统状况通过推进屏障修复。然而,在早期超声塑性加工研究有益的影响被推迟,直到几周后细胞移植,甚至一些严重受损的毛细血管被发现后高剂量治疗。所以在这项研究中,研究人员测试了人类EPCs-cells收获来自骨髓,但比未分化的干细胞基因类似于血管内皮细胞细胞提供更好BSCB恢复。
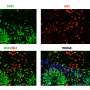
肌萎缩性侧索硬化症小鼠静脉注射剂量的人类骨髓内皮祖细胞。移植后4周,活跃的细胞治疗的结果对比发现其他两组的老鼠:肌萎缩性侧索硬化症小鼠接受媒体(生理盐水)治疗和未经处理的健康的小鼠。
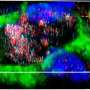
ALS症状的老鼠接受EPC治疗显著改善运动机能,增加运动神经元生存和慢疾病进展比有症状的同行注射媒体。研究人员认为,这些好处导致BSCB修复可能已经被广泛的毛细血管的内皮祖细胞脊髓的依恋。支持这个提议,他们指出,大幅恢复毛细血管的证据,减少毛细血管渗漏,重建结构支持细胞(血管周的星形胶质细胞)发挥作用,帮助形成一个保护屏障脊髓和大脑。
进一步的研究需要明确定义EPC屏障修复的机制。但是,这项研究的作者得出结论:“从转化的观点,起始细胞治疗有症状的疾病阶段提供强劲的恢复BSCB完整性和显示承诺成为未来临床治疗ALS。”
更多信息:Svitlana Garbuzova-Davis et al,人类骨髓内皮祖细胞移植到老鼠ALS症状延迟疾病进展和增加运动神经元生存修复Blood-Spinal绳障碍,科学报告(2019)。DOI: 10.1038 / s41598 - 019 - 41747 - 4