一种新确定的机制可以靶向促进血管生成
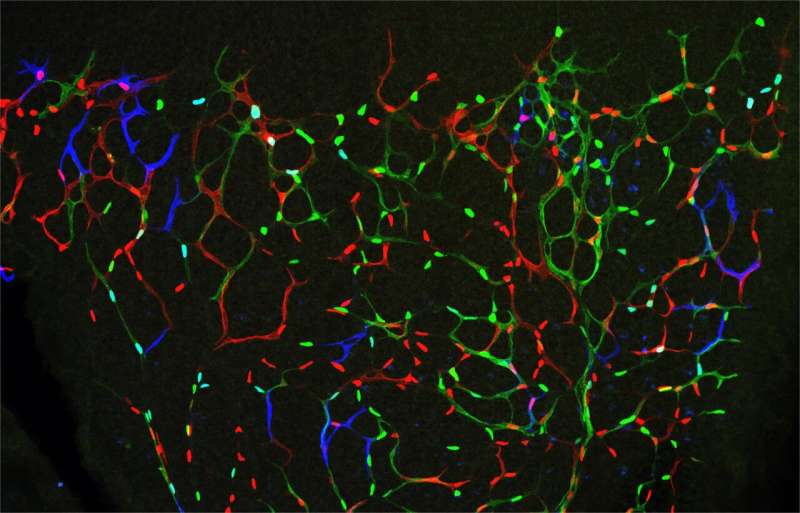
由Rui Benedito领导的国家心血管研究中心(CNIC)的科学家们发现了一种细胞和分子机制,可以利用该机制在由于血液供应减少而缺血的组织中诱导产生和持续的血管新生。
到目前为止,基于血管生长因子的组织再生治疗尚未取得有效的诱导效果血管生成,身体产生的过程新血管。研究结果发表在自然通讯,表明有可能操纵新发现的东西机制以达到最佳的治疗性血管生成。
就像公路和高速公路连接着城市,使城市得以发展和运作一样,身体的血血管是组织发育和功能所必需的。抑制血管生长是癌症的一个重要治疗目标,而在心血管疾病中,诱导血管生成有可能促进新血管的形成和组织再生。
在过去的20年里,科学家们已经证明,每个组织中血管的适当生长依赖于若干分子促血管生成和抗血管生成机制的正确平衡。缺血或缺氧组织分泌血管内皮生长因子(VEGF),通过诱导血管细胞的增殖和迁移促进血管生成。Rui Benedito团队之前的研究表明,血管细胞通过一种叫做Notch的细胞间配体-受体信号机制来抵抗和反对这些外部的有丝分裂信号。
目前流行的观点是血管内皮生长因子浓度的增加或血管Notch信号通路的减少同时刺激血管细胞的增殖和船增长。因此,旨在刺激有丝分裂和血管生成来治疗心血管疾病的策略是基于促进VEGF信号传导或阻断自然血管生成抑制剂如Notch的药物。
Rui Benedito的团队使用复杂的基因小鼠模型和细胞成像工具,现在已经发现这些药物的作用和信号机制随着血管生成阶段和血管环境的变化而变化。
研究结果自然通讯研究表明,VEGF诱导的高有丝分裂刺激(或Notch抑制)可以抑制血管生成血管的增殖,同时诱导更成熟的血管的增殖,而在疾病背景下,成熟的血管对有效的血管生成并不重要。“血管生成的停止是由于对有丝分裂刺激的钟形剂量反应。在高水平的有丝分裂刺激下,内皮细胞迁移和分支,但不增殖。最终,这会影响血管的可持续发展和周围组织的生长或再生,”Rui Benedito说。
新发现的机制也可以解释在心肌梗死后寻求促进缺血心脏血管生成的几个临床试验的失败。Rui Benedito说,该结果“显著增加了我们对血管生物学的理解,并将使我们能够设计更好的治疗策略,在受伤或缺血组织中诱导有效的血管生成。”
进一步探索













用户评论