失去肌肉脂肪:误导驱动LGMD2B多能干细胞的命运

研究由教师在儿童国家6月3日在线发表于2019年自然通讯显示症状的突然出现肢带肌萎缩症2型(LGMD2B)是一个结果不同细胞类型之间的沟通障碍,促进修复健康的肌肉。特别感兴趣的是纤维/脂肪形成的前体(fap),细胞通常发挥有益作用在再生肌肉损伤后清除杂物和提高肌肉细胞的融合到新的肌纤维。
LGMD2B是由DYSF基因的突变引起的损害dysferlin的功能,蛋白质修复受伤的关键肌肉纤维。症状,如难以攀爬或运行,不会出现在年轻病人,直到成年。这晚发型一直困扰研究人员,随着细胞的后果dysferlin不在存在从出生和持续发展,但不影响病人直到在以后的生活中。
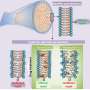
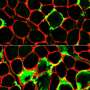
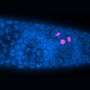
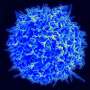
研究发现,在没有dysferlin,肌肉逐渐增加表达的蛋白质膜联蛋白A2, dysferlin、促进修复受伤的肌肉纤维。然而,增加肌肉纤维外膜联蛋白A2积累和驱动器fap的增加肌肉内以及鼓励这些向脂肪细胞分化fap,形成脂肪沉积。关闭膜联蛋白A2或阻塞的脂肪细胞命运fap使用现成的药逮捕dysferlinopathic肌肉的脂肪替代品。
“我们提出一个前馈回路中重复肌纤维损伤引发的慢性炎症,随着时间的推移,创建一个环境,促进fap积累和分化成脂肪。反过来,这导致更多的肌纤维损伤,”Jyoti k·贾斯瓦尔说,硕士,博士,遗传医学研究中心的首席研究员在孩子的国家和该研究的资深作者。
“脂肪形成的积累成为成核事件,导致肌肉功能的病人突然下降。这个新观点LGMD2B疾病打开以前未实现途径进行干预,”马歇尔贺加斯补充道,博士,该研究的第一作者。
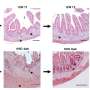
贾斯瓦尔领导的研究小组与爱德华·盖拉多和乔迪·迪亚兹Manera,医院de la圣Creu在巴塞罗那,西班牙,检查肌肉活检的患者LGMD2B有轻微到严重的症状。他们发现脂肪形成的存款产生的细胞外基质的肌肉纤维之间的空间,与积累的程度与疾病严重程度。他们发现一个类似的进步增加脂质积累肌纤维预测疾病严重程度之间dysferlin-deficient实验模型。更重要的是,这个过程可以加速肌肉损伤,引发地区增加脂肪形成的更换,否则会被肌肉细胞。
“积累和脂肪形成的差异化fap负责dysferlinopathic肌肉功能的下降。扭转这可以提供一个治疗LGMD2B,毁灭性的疾病,没有有效的治疗方法,”贾斯瓦尔的团队一直在这个领域的研究。
有现成的药物包括batimastat、一种抗癌药物,抑制细胞外基质酶基质金属蛋白酶。这种药物可以降低FAP体外,减少脂肪生成injury-triggered脂质在体内形成。在实验模型中,batimastat也增加肌肉功能。
更多信息:自然通讯(2019)。DOI: 10.1038 / s41467 - 019 - 10438 - z