蛋白质显示承诺在治疗帕金森病

帕金森病的真正原因研究人员仍然是一个谜,尽管他们确实知道在许多患者,蛋白α-突触核蛋白(aSyn)倾向于聚集在脑细胞。但不同的蛋白质可以帮助阻止聚合,根据一项新的研究分子生物学杂志。
炒作,唯一Fic蛋白质中发现的人类,是一个主要的监管机构是否细胞是死是活在压力之下。为了正常工作,需要蛋白质折叠正确的形状。当细胞被强调,他们的蛋白质可以成为错误折叠,此时他们可以聚合并成为有毒。细胞感觉压力通过评估错误折叠的蛋白质的量。
“既然炒作扮演如此重要的角色从错误折叠的蛋白质在细胞如何应对压力,我们想知道蛋白质错误折叠而导致的疾病可能需要炒作,“说Seema Mattoo)普渡大学生物科学助理教授。“我们知道在帕金森氏症疾病,经常aSyn错误折叠的蛋白质。所以我们问炒作是否可以修改aSyn,如果是这样的话,后果是什么?”
研究表明,宣传并修改aSyn-and这个新的修改,称为AMPylation,降低聚合。
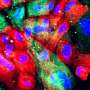
aSyn团,称为路易小体,是帕金森病的病理特点。聚合aSyn必定会对神经元的细胞膜,导致神经功能下降,弄乱神经细胞如何沟通。
找出如果低聚合aSyn实际上相当于少戳洞,约翰•克利斯朵夫Mattoo与白色法衣,药物化学和分子药理学教授普渡,模仿使用不同的脂质膜,然后比较如何修改和未修改的aSyn表现反对它。脂质含有染料,将泄漏如果孔戳。
“我们发现少修改aSyn染料被释放,这意味着膜保持更完整,“说Mattoo)也是一位普渡大学研究所的炎症,免疫学和传染性疾病和癌症研究中心。“这意味着炒作可能对帕金森病治疗效果。”
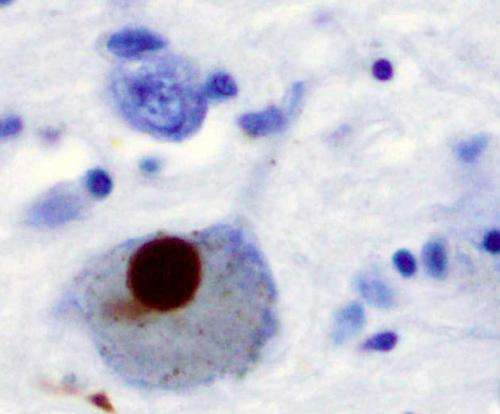
在这项研究之前,AMPylation aSyn,降低聚合,从未见过的。许多蛋白质的变化自然发生的,但他们倾向于增加聚合。
当Mattoo的团队观察修改aSyn在电子显微镜下,他们还发现,蛋白质的结构发生了变化。正常aSyn往往扭曲,从而促进聚合。但是新的、修改版本不如它扭曲形式平行纤维,这可能是为什么它总量少,Mattoo说。
约有60000美国人被诊断为帕金森病,每年影响大约1%的60岁以上的人口。它体现在颤抖、刚度和行走困难,平衡和协调能力,以及心理和行为变化。没有治愈疾病,但药物治疗可以帮助减少症状。
帕金森病很难治疗,因为它的真正原因了解甚少,也没有人知道真正的aSyn的函数。研究人员知道其聚合促进疾病,但为什么细胞允许它总在第一时间?为什么aSyn开始吗?虽然aSyn的确切的生物功能仍是未知之数,研究人员正在犹豫是否要攻击蛋白质因为它对神经细胞的生存很重要。
“我们都试图应用一个创可贴的疾病进展,因为我们知道聚合导致细胞变得有毒,但我们如何阻止?”Mattoo said. "There is still much to be understood mechanistically about it in the context of disease."
研究了体外,但下一个步骤是将它移动到大脑细胞,然后变成一个动物模型。
“我们在早期阶段,但是这些结果为我们提供一个新的角度观察潜在的治疗,”Mattoo说。“我们试图想出的药物可以用来操纵宣传活动。你可以给病人开始表现出帕金森或容易聚合aSyn。这是我们想要去的方向。”
更多信息:Anwesha Sanyal et al .α-突触核蛋白的目标Fic-Mediated腺苷酰化作用/ AMPylation:可能影响帕金森病,分子生物学杂志(2019)。DOI: 10.1016 / j.jmb.2019.04.026