研究确定了蛋白质负责机制背后的骨质流失

加州大学洛杉矶分校牙科学院的研究人员提供了洞察骨质流失的机械过程如何工作,也负责回收分离出一种蛋白质的细胞,还可以促进骨质流失。研究小组显示,通过消除骨质流失的关键蛋白质负责激活,有骨质流失的潜在控制水平的一个人。
骨质疏松症是一种骨质流失条件,可能会导致严重的医疗问题。大约1000万美国人获得诊断骨质疏松症和一个额外的4400万低骨密度。骨质疏松的主要罪魁祸首是破骨细胞,这是细胞骨分解和工作与成骨细胞,这些细胞负责骨形成,维持骨体积。但是当这些破骨细胞over-perform他们的功能,结果损失在骨密度和骨。
众所周知,RANKL、蛋白质的影响免疫系统和控制骨再生,在破骨细胞被激活中起着至关重要的作用,但实际蛋白质调节的机制破骨细胞骨质流失的途径并不是完全理解。在这项研究中,研究人员开始更好地理解RANKL在指导破骨细胞的作用,促进骨质流失,是否有可能有一种方法来控制通路对骨再生和骨生长。
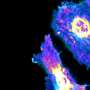
研究人员集中研究自噬,在破骨细胞或细胞再生过程,为了找出RANKL促进骨质流失的原因。众所周知,自噬的激活主要在细胞压力,如饥饿。然而,有越来越多的证据表明自噬可以通过信号通路被激活,细胞功能可以控制。
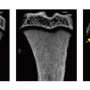
他们开始通过检查Beclin1,自噬起始不可或缺的蛋白质,结合RANKL-activated细胞,在体外细胞和体内(在工作生物体对老鼠的研究。团队评估的几款Beclin1-enhanced组合和得出结论,Beclin1的超表达蛋白是细胞改变成破骨细胞直接相关。他们更进一步发展小鼠模型他们消除Beclin1在破骨细胞和结果更厚的皮质骨,这是骨组织密度比其他类型,占80%的人类的骨架的重量。
根据美国国家骨质疏松症基金会,专家预测,到2025年,骨质疏松症将负责300万骨折,导致253亿美元的医疗卫生相关的成本。针对破骨细胞自噬的研究人员的方法将是一个宝贵的战略方法防止病理,或-淋,骨质流失和可能导致改善骨质疏松症的治疗骨坏死的下巴,一个条件在颚骨细胞分解或死亡。
进一步探索








用户评论