发现了更好的长期治疗控制不良哮喘的药物
随着时间的推移,药物疗效的下降仍然是治疗包括哮喘在内的疾病的主要挑战。
有一半的中度至重度哮喘患者仍然无法用现有药物对这种慢性疾病的炎症和气道收缩成分进行最佳控制。控制不好的哮喘会导致呼吸短促、运动不耐受和住院治疗。
为了找到副作用更少的精确治疗方法,Stephen B. Liggett医学博士和南佛罗里达健康大学(USF健康)莫尔萨尼医学院的同事们研究了五种药物(称为激动剂)的不同结构变化如何影响它们治疗气道阻塞的长期能力。他们调查了这五种药物是如何调节血压的苦味感受器被称为tas2r14,一种在人气道上表达的G蛋白偶联受体(GPCR)平滑肌在肺部深处。
USF健康临床前研究8月20日在网上发表FASEB期刊.
目前的研究建立在资深作者Liggett博士先前工作的基础上,表明苦味受体激动剂似乎优于目前为哮喘患者开气道的吸入β -激动剂。在FASEB论文中,USF健康跨学科研究小组报告了一种药物苯海拉明(DPD),一种TAS2R14激动剂,在最大限度地减少TAS2R14表达的长期损失和维持长期扩张气道所需的信号方面明显优于其他四种药物。
“这项研究的目标是看看我们选择的tas2r14靶向药物如何与受体相互作用,以维持放松气道平滑肌的信号,而不随着时间的推移而失去这种治疗功能,”USF健康莫尔萨尼医学院研究副院长、内科、分子药理学、生理学和医学工程教授Liggett博士说。“我们是第一个证明有可能通过一种药物使气道GPCR激活偏向于一个非常有利的治疗结果。”
他补充说,这一结果——即使重复给药也能改善气流——表明有能力更好地持续控制中度至重度哮喘。
“我们的哮喘治疗组合需要能够直接打开气道来治疗急性发作的药物,即救援药物,以及那些预防发作的药物,即控制药物。但目前所有这些都是β -激动剂,”利格特博士解释道。“我们已经开始寻找激活完全不同通路的药物,这样它们就可以补充或取代现有的药物。”
他说,当一种药物的效力减弱时,几乎没有其他选择。有时,更高的剂量或更频繁的剂量可能会有所帮助,但这可能会导致更多的反应下调,并造成恶性循环。加速给药也会引起更大的副作用。
GPCRs是细胞膜受体,它接收来自细胞外其他分子的信息,包括药物。这些受体向细胞内部发出信号,执行一种或多种功能。在苦味受体TAS2R14的情况下,受体的激活触发了收缩的气道的放松。
然而,随着长时间接触药物,TAS2R14和许多其他GPCRs会降低它们对结合并激活它们的药物的生理反应。这种“脱敏”意味着相同剂量的药物原本效果很好,但现在不再有效了。这一过程涉及一系列事件,包括目标细胞膜表面受体数量的减少和细胞信号中断,所有这些都导致治疗效果较差。
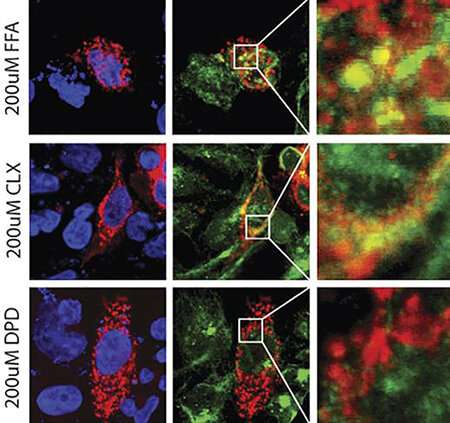
USF健康研究人员创建了活的人类气道平滑肌细胞的细胞模型,以研究五种结构不同的现有TAS2R14激动剂,包括具有抗菌、抗炎、血管扩张和缓解疼痛特性的药物。他们研究了哪些药物表现出偏离(没有促进)TAS2R14的脱敏,但仍然激活了这种苦味受体。
他们还使用了一种称为分子对接的计算机模型来帮助确定为什么药物DPD与TAS2R14结合位点的相互作用不同于大多数其他药物。简单地说,他们的对接模拟可以预测哪把钥匙(药物)最适合锁(受体口袋),以唤起受体的特殊非脱敏状态。
该研究的一些主要发现包括:
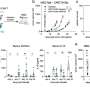
- 苦味受体TAS2R14暴露在这5种药物中18小时。长期治疗后,只有DPD表现出轻微脱敏。
- 除DPD外,其余药物均诱导气道平滑肌细胞表面的受体向细胞内部移动,并最终降解。这使得细胞表面与药物相互作用的受体减少,因此整体治疗反应降低。
- 分子对接表明DPD在受体结合袋深处有接触点,而其他四种药物没有观察到。作为进一步的测试,与DPD结构相似的第六种化合物(orphenadrine)也停靠在TAS2R12上。与DPD一样,orphenadrine与受体上相同的接触点一致,没有受体下调。激动剂与苦味受体的“最佳匹配”可能会以促进最佳药物反应的方式稳定受体的形状,同时避免下调(以及伴随的损失)受体),研究人员建议。
利格特博士说,总的来说,这项新研究表明,通过操纵现有药物的结构,或发现结构特征最适合靶向受体独特形状的新药,可以促进对难治性哮喘的长期控制。“这就像通过使用药物把它弯曲成更适合病人的形状。”
更多信息:Jung A. Woo等,结构不同的激动剂对TAS2R14的差异长期调控,FASEB期刊(2019)。DOI: 10.1096 / fj.201802627RR