研究小组发现了一种有助于调节血糖和血脂的蛋白质
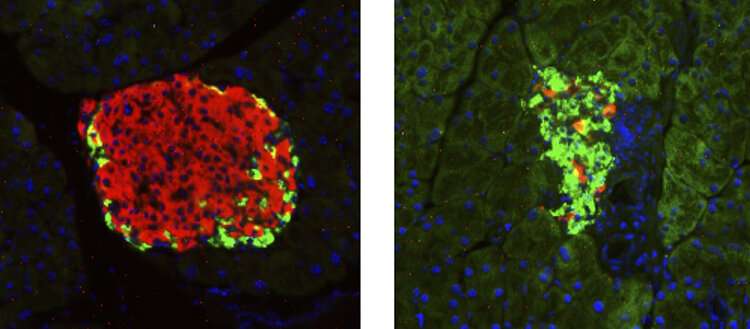
胰岛素是调节血糖和血脂所必需的激素,通常由胰腺β细胞产生。然而,在许多糖尿病患者中,胰腺细胞没有(或不再)功能,导致慢性和潜在致命的胰岛素缺乏,只能通过每天注射胰岛素来控制。然而,这种方法有严重的副作用,包括增加危及生命的低血糖风险,并且不能恢复代谢平衡。为了改善治疗,瑞士日内瓦大学(UNIGE)的研究人员发现了一种名为S100A9的蛋白质,在某些条件下,它似乎可以作为血糖和血脂调节器,同时避免胰岛素最有害的副作用。这个发现,可以读进去自然通讯这项研究为更好地治疗糖尿病铺平了道路,并可能显著改善数千万胰岛素缺乏患者的生活质量。
今天,胰岛素注射对于1型糖尿病或严重2型糖尿病患者的生存至关重要。然而,这种治疗并非没有风险:过量会引发低血糖,即血糖下降血糖水平这会导致昏迷甚至死亡。但如果剂量不足,会导致同样危险的高血糖。此外,胰岛素还参与控制酮类物质,酮类物质是在葡萄糖储备不足的情况下,肝脏分解脂质时产生的,过量会产生毒性。此外,长期胰岛素治疗会导致血液中脂肪和胆固醇过量,从而增加心血管疾病的风险。
早在2010年,罗伯特·科帕里(Roberto Coppari)的团队就强调了瘦素(leptin)调节葡萄糖和脂肪的特性,瘦素是一种控制饥饿感的激素。“然而,由于瘦素耐药性的发展,瘦素已被证明难以在药物上用于人类,”罗伯托·科帕里说。“为了克服这个问题,我们将研究重点转移到瘦素引发的代谢机制上,而不是激素本身。”
尽管名声不好,但它是一种有效的蛋白质
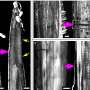
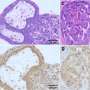
科学家们观察了注射瘦素的胰岛素缺乏小鼠血液中的变化,并注意到S100A9蛋白的大量存在。“这种蛋白质名声不好,因为当它与它的姐妹蛋白S100A8结合时,它会产生一种叫做钙保护蛋白的复合物,导致许多炎症或自身免疫性疾病的症状,”UNIGE医学院糖尿病中心的研究员、这项工作的第一作者Giorgio Ramadori说。“然而,矛盾的是,通过过度表达S100A9,我们可以减少其与S100A8的有害组合,从而抑制钙保护素水平。”
然后,研究人员给胰岛素缺乏的糖尿病小鼠服用了高剂量的S100A9,发现葡萄糖管理得到了改善,酮类和脂类的控制得到了更好的控制,这两种代谢异常在胰岛素缺乏患者中很常见。
为了更好地了解这种机制如何转化为人类,Coppari教授的团队目前正在与日内瓦大学医院合作,对具有非常高的葡萄糖和酮水平的1型和2型糖尿病患者进行临床观察研究。他们想要确定血液中S100A9水平与症状严重程度之间的相关性。“在人类中,之前的研究已经表明,S100A9水平的增加与糖尿病风险的降低有关;因此,这些结果进一步加强了我们数据的临床相关性。因此,我们目前正在努力进行I期人体临床试验,直接测试S100A9在胰岛素缺乏症中的安全性和有效性,”Roberto Coppari说。
转向联合治疗
研究小组随后又有了第二个发现:S100A9蛋白似乎只有在TLR4存在的情况下才起作用,TLR4是一种位于某些细胞(包括脂肪细胞或免疫系统细胞)膜上的受体。“为什么?目前,它仍然是个谜,”罗伯托·科帕里说。研究人员目前正在研究一种结合低剂量胰岛素和S100A9的治疗方法,以更好地控制葡萄糖和酮类,并限制高剂量胰岛素的副作用。“我们还想破译TLR4的确切作用,以便提供一种治疗策略,实现最佳血糖、酮和血脂控制的微妙平衡。”
风险是很高的:数千万人一生中每天都要服用胰岛素,这种治疗通常很难平衡患者和护理人员。Roberto Coppari和他的团队提出的新的治疗策略可以极大地提高他们的生活质量。