基因编辑的白细胞是如何帮助对抗癌症的
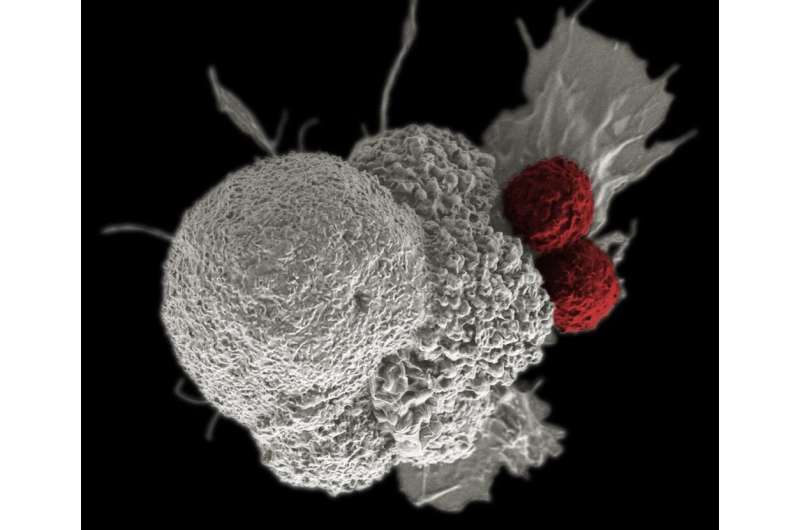 Rita Elena Serda, Duncan Comprehensive Cancer Center at Baylor College of Medicine, National Cancer Institute, National Institutes of Health, CC BY-NC" width="800" height="530">
Rita Elena Serda, Duncan Comprehensive Cancer Center at Baylor College of Medicine, National Cancer Institute, National Institutes of Health, CC BY-NC" width="800" height="530">
在美国,基因编辑工具首次被用于治疗三名晚期癌症患者,并显示出良好的前景早期的研究结果在试验第一阶段临床试验.到目前为止,这种治疗似乎是安全的,预计很快会有更多的结果。
发展更安全、更有效的治疗为癌症病人,科学家从宾夕法尼亚大学,帕克癌症免疫治疗研究所在旧金山Tmunity疗法该公司开发了一种免疫疗法的高级版本。在这种治疗中,患者自身免疫细胞都是从身体里取出来的,专门训练识别的吗癌症细胞最后被注射回病人体内在那里它们繁殖并摧毁它们。
与化疗或放射治疗直接杀死癌细胞的免疫疗法激活人体自身的免疫系统来完成这项工作。该团队使用了一种名为CRISPR的基因编辑工具来改变免疫细胞将它们变成训练有素的士兵,定位并杀死癌细胞。通过使用这种技术,该团队希望开发出一种副作用最小的更有效的免疫疗法。
我被训练成药学科学家生物分子工程师,我对这种新疗法特别感兴趣,因为我的实验室专注于编辑基因编辑器。特别是,我正在尝试开发更好的基于crispr的基因编辑器,用于癌症和其他疾病的诊断和治疗。我们结合化学、生物学和纳米技术,更有效、更精确地设计、控制和交付基因编辑工具。
训练免疫细胞发现并杀死癌症
制造这些用于癌症药物试验的肿瘤杀伤细胞的第一步是从癌症患者的血液中分离出t细胞——一种对抗病原体和癌细胞的白细胞。2例晚期患者多发性骨髓瘤还有一个病人黏液样/圆细胞脂肪肉瘤都参与了这项研究。
为了在不伤害正常细胞的情况下武装t细胞并增强其抗肿瘤能力,科学家们对t细胞进行了基因改造——使3个基因丧失活性,增加1个基因——然后将它们归还给患者。
前两个被删除的基因编码t细胞受体,这是一种在t细胞表面发现的蛋白质,可以识别和结合癌细胞上被称为抗原的特定分子。当这些工程t细胞与这些抗原结合时,它们就可以攻击并直接杀死癌细胞。但问题是,一个t细胞可以识别体内多种不同的抗原,使它们不那么专注于寻找癌细胞。通过消除这两个基因,t细胞不太可能攻击错误的目标或宿主,这种现象被称为自身免疫,
此外,他们破坏了第三个基因,称为程序性细胞死亡蛋白1,它会减缓免疫反应。使程序性细胞死亡蛋白1基因失效可以提高t细胞的效率。
转化这些细胞的最后一步是添加一种能产生一种新的t细胞受体的基因,这种受体能识别并抓住癌细胞上一种叫做NY-ESO-1的特殊标记。3个基因被删除,1个基因被添加,t细胞已经准备好对抗癌症。

CRISPR在临床试验中处于什么位置?
那么这个团队究竟是如何编辑t细胞的呢?他们利用了CRISPR/Cas9基因编辑技术,该技术使用了两个组成部分:一个导向的CRISPR分子,可以找到并结合目标基因位点;以及分子剪刀Cas9,它可以剪断DNA,最终使基因失效。
研究小组使用了电穿孔技术,一种在细胞膜上制造临时孔的技术,将Cas9蛋白和靶向数百万t细胞中感兴趣的三个基因的导向分子一起传递出去。
在用CRISPR破坏了这三个基因后,研究小组用一种安全的灭活病毒向t细胞传递一种基因,使其能够识别癌症特异性标记物ny - eso -1。删除这些基因从数百万细胞中分离出来,然后让t细胞在体外的培养皿中繁殖成数十亿细胞,这可能需要几天到几周的时间。
在注射经过crispr修饰的t细胞的四天前,研究小组给三名患者每人注射了几剂化疗药物,以耗尽他们体内现有的白细胞。
最后,大约每公斤1亿个改良t细胞以单次输注的方式注入患者体内。
CRISPR前景广阔
在注射t细胞后的前28天,研究小组对患者进行了持续监测。然后,他们每月随访6个月;之后每三个月监测一次免疫反应等不良事件。t细胞疗法通常与各种副作用有关,如发烧、肌肉疼痛、头痛、精神错乱、癫痫、低血压、出血障碍和多器官功能障碍。研究小组在任何病人身上都没有发现毒性迹象,这是令人兴奋的。
但第一个晚期多发性骨髓瘤患者在60天后肿瘤继续生长。虽然第一个病人的治疗似乎不太成功一期临床试验主要是为了测试安全性,该团队报告称没有对任何患者产生毒性。
第二例晚期粘液样/圆形细胞脂肪肉瘤患者使用连续CT扫描监测,90天后似乎稳定。第三位患有多发性骨髓瘤的患者最近开始了试验,现在还为时尚早,无法得出任何结果。事实上,这种基于crispr的基因编辑技术的新疗法没有严重的毒性问题癌症患者是迈向临床广泛应用的重要一步。