AQAMAN瞄准罕见的神经退行性疾病
一种被称为AQAMAN的合成小分子化合物可以预防甚至逆转神经元中有害蛋白质的积聚,这些蛋白质与几种罕见的神经退行性疾病有关,包括聚谷氨酰胺(或polyQ)疾病。
患有多发性q疾病的人,如亨廷顿舞蹈症和马查多-约瑟夫病,肌肉失去控制和协调能力神经细胞慢慢地死在他们的脑子里。他们在平衡和步态,以及说话和吞咽方面越来越困难。这些遗传性疾病是由基因突变都是无法医治的。药物疗法都是急需的。
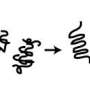
香港中文大学(中大)的生物化学家Edwin Chan在过去20年里一直在研究多q疾病。他专注于研究神经元中的蛋白质如何以错误的方式折叠,以及这些错误折叠的蛋白质如何形成有毒的团块,从而导致细胞死亡.
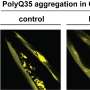
AQAMAN是马查多-约瑟夫相关神经退行性变的Anti-polyQ Aggregation的缩写,是伊利诺伊大学厄巴纳-香槟分校的Steven Zimmerman及其同事合成的一种分子。它最初是用来治疗肌肉萎缩症的。在体外和体内测试AQAMAN果蝇, Chan的团队,包括香港中文大学的同事Jacky Ngo,发现这种化合物可以抑制神经元中有毒的polyQ蛋白的积累。
Chan说:“我们惊讶地发现AQAMAN干扰神经细胞中的有毒蛋白质聚集,并希望它能导致新的治疗方法,为患有多q障碍的人带来缓解。”
该团队曾预计AQAMAN将针对已知会产生有毒蛋白质的缺陷RNA分子。然而,他们的分析发现AQAMAN实际上会导致蛋白质分散并被移除,这是细胞正常的“自噬”过程的一部分,在这个过程中,细胞会消耗受损的部分或废物。AQAMAN分子与有毒蛋白质的可溶性形式结合,但需要进一步研究以更详细地了解扩散机制。
这些研究结果被刊登在了生物化学杂志,可以为治疗多q疾病的新药的开发提供信息。该团队下一步计划在动物模型上测试AQAMAN的有效性。在考虑用于人类治疗之前,还需要开发药物输送策略。