脑瘤改造神经元突触以促进生长

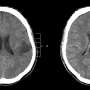
贝勒医学院(Baylor College of Medicine)的科学家们发现了新的证据,证明胶质瘤(一种致命的脑癌)会改变邻近神经元的活动,加速恶性循环,推动肿瘤相关癫痫和肿瘤进展。
他们的研究结果发表在自然,表明PIK3CA基因的几种变体驱动肿瘤特别是这两种变异改变了参与突触的基因的表达,突触是神经元交流的连接点。
“使用一种新的功能基因组学策略,我们的研究揭示了胶质瘤细胞和邻近神经元之间的动态相互作用,”通讯作者、神经外科教授、干细胞和再生医学中心的本杰明·迪宁博士说。“在这方面,胶质瘤肿瘤表现出马基雅维利式的行为——胶质瘤细胞将神经元微环境改造为过度活跃,这反过来又反馈给肿瘤,促进其自身的生长。”
识别导致胶质瘤的基因变异
这项研究的最初目标是开发一个实验系统,使研究人员能够在脑瘤小鼠模型中识别新的癌症基因。为了实现这一目标,Deneen实验室和贝勒大学的合著者Kenneth L Scott博士开始了合作。他们一起通过基因工程将他们的胶质瘤小鼠模型改造成一种新型的高通量筛选平台,以识别这些PIK3CA变体。
利用他们的新型筛选平台,研究人员发现了驱动胶质瘤发展的几种PIK3CA变体。其中两种PIK3CA变体,命名为C420R和H1047R,因为它们是肿瘤发展的最强驱动力。有趣的是,在C420R和H1047R胶质瘤中特异性表达的一些基因参与了突触的形成,这表明肿瘤可能会影响邻近神经元的突触平衡。
“这些基因变异产生的蛋白质只在一种氨基酸(蛋白质的组成部分)上有所不同,但其中一些变异产生的肿瘤具有与其他基因完全不同的分子特征。这非常令人惊讶,并告诉我们,看似相似的PIK3CA变体通过非常不同的机制促进胶质瘤的形成,”Deneen说,他也是Dan L Duncan综合癌症中心的成员,并在贝勒大学担任Marianne and Russell Blattner主席。
胶质瘤为其自身的发展创造了有利条件
为了研究这些不同的机制,Deneen和同事们专注于突触基因签名,假设这些突触基因表达的改变可能导致癫痫发作,网络过度兴奋性和胶质瘤小鼠模型的直接突触变化。为了进行这些研究,Deneen与合著者Jeffrey L Noebels博士合作,Jeffrey L Noebels博士是神经学、神经科学、分子和人类遗传学教授,贝勒大学卡伦医疗保健基金会神经遗传学捐赠主席。
Deneen说:“突触不平衡会导致神经元网络连通性和兴奋性的广泛变化,在某些情况下会导致癫痫发作。”“癫痫发作在胶质瘤中是典型的,但潜在的细胞和遗传机制尚不清楚。我们将这一发现作为一个机会,探索不同的PIK3CA变体是否可以诱导胶质瘤中的癫痫,并更多地了解肿瘤促进神经元过度兴奋的机制。”
他们的研究表明,由C420R和H1047R变体驱动的胶质瘤确实促进了肿瘤周围神经元的过度兴奋性的早期发作,并通过诱导突触形成来重塑突触网络。携带这些肿瘤的小鼠发作的时间比携带其他PIK3CA变体驱动的肿瘤的小鼠早得多。
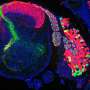
深入研究C420R和H1047R胶质瘤对其微环境影响的机制,研究人员发现这些胶质瘤选择性地分泌几种glypican (GPC)家族分子,GPC3驱动过度兴奋性和突触重塑。此外,他们发现GPC3本身可以促进胶质瘤的形成。
这些发现为神经胶质瘤衍生的机制提供了第一个证据,该机制操纵神经元微环境肿瘤进展。
“我们已经发现了胶质瘤细胞改变神经元以在大脑中建立支持生长的环境条件的中心机制。治疗上,我们正在积极检查短路神经胶质瘤神经元之间的通信可以用来治疗这些恶性脑肿瘤患者。”