脂溶性胆汁酸可能有助于调节肠道免疫和炎症

胆汁酸——肝脏和胆囊产生的溶解脂肪的汁液——也能在免疫和炎症中发挥作用吗?
答案似乎是肯定的,根据出版的两个单独的哈佛医学学习研究自然.
两项研究的结果,两者都在小鼠中进行,表明胆汁酸促进了若干类型的T细胞的分化和活性,参与调节炎症并与肠炎症条件相关联。他们还揭示了肠道微生物对于将胆汁酸转化为免疫信号分子至关重要。
该作品表明,用于调节肠炎的可能治疗途径,这是一个基于自身免疫条件的发展的过程,如炎症性肠病,通常被称为IBD。
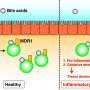
第一项研究由免疫学家Jun Huh领导,并于11月27日发表于自然,揭示胆汁酸通过与肠道中的免疫细胞相互作用来发挥其免疫调节效果。一旦胆汁酸会留下胆囊并完成其脂肪溶解的职责,他们将通过肠道细菌修饰到免疫调节分子中的消化道。然后改性胆汁酸活化两类免疫细胞:调节性T细胞(Tregs)和效应辅助T细胞,特别是Th17,每个Th17通过抑制或促进炎症调节免疫应答。
在正常条件下,促炎致炎细胞和抗炎Treg细胞的水平彼此平衡,维持对病原体的一种保护程度,而不会导致过多的组织损伤炎症。这些细胞在肠道感染的背景下发挥着关键作用。Th17细胞点燃炎症以平息感染,而Tregs在威胁消退后抑制炎症。无拘无束,Th17的活性也可能导致异常炎症,促进自身免疫性疾病并损害肠道。
在他们的实验中,研究人员使用未分化的(naïve)小鼠T细胞,并将它们暴露在各种胆汁中酸代谢物一次。实验表明,两种单独的胆汁酸分子对T细胞产生不同的影响 - 一种分子促进的Treg分化,而另一个分子抑制了Th17细胞分化。当研究人员向小鼠施用每种分子时,他们观察到动物的TH17和Treg细胞相应地下降并升起。此外,研究人员发现,两种胆汁酸副产物也存在于人类粪便中,包括IBD的人们的粪便 - 一个发现相同机制在人类中扮演的机制。
HMS布拉瓦特尼克研究所的免疫学助理教授Huh说:“我们的发现确定了肠道免疫的一个重要调节机制,表明我们肠道中的微生物可以修改胆汁酸,并将其转变为炎症调节因子。”
如果在进一步的研究中肯定,结果可以向靶向Treg和Th17细胞的小分子疗法的发展为控制影响肠道的炎症和治疗自身免疫疾病的一种方法。
第二项研究发表于12月25日自然由Dennis Kasper引导,聚焦在炎症 - 驯服调节性T细胞或Tregs的子集上,因为暴露于肠道微生物而产生的结肠。相比之下,大多数其他免疫细胞起源于胸腺。
低水平的结肠调节性T细胞(结肠treg)已经被认为与自身免疫性疾病如IBD和克罗恩病的发展有关。
刺激者的实验表明,肠道微生物和饮食协同工作,以改变胆汁酸,这反过来影响小鼠的结肠菌量水平。他们还表明,由于胆汁酸缺乏含有胆汁酸或胆酸传感器的缺乏的低水平的特雷格细胞使得易患炎症性结肠炎 - 模仿人IBD的病症。
为了验证肠道细菌将食物产生的胆汁酸转化为免疫信号分子的假设,研究人员沉默了各种肠道微生物中胆汁酸转化基因,然后将经过修饰和未修饰的微生物都放在专门培养的无菌肠道小鼠身上。肠道中没有胆汁酸转化基因的微生物的动物的Treg细胞水平明显较低。然后研究人员给动物喂食营养丰富的食物或少量食物。
与吃丰富食物的小鼠相比,肠道中微生物数量正常但食物摄入较少的小鼠结肠treg和胆汁酸水平较低。然而,肠道无菌、食物丰富的动物的Treg细胞水平也很低——这一发现表明,肠道微生物和食物来源的胆汁酸都是调节免疫细胞水平所必需的。
为了测试胆汁酸是否直接参与免疫细胞调节,研究人员然后将各种胆汁酸分子与Treg细胞水平低、饮食少的动物的饮用水混合。几周后,这些动物的抑制炎症的Treg水平有所增加细胞.
在最后一步中,研究人员给了三组小鼠诱导结肠炎的化合物。一组饮食最少,另一组接受了富含营养丰富的膳食,第三组接受了含有胆汁酸分子的最小食物和饮用水。正如预期的那样,只有喂食未通过胆汁酸分子补充的小鼠的小鼠显得显良。实验证实,胆汁酸在Treg调控中发挥着关键作用,肠炎症和结肠炎风险。
“我们的结果展示了优雅的三通相互作用肠道微生物,胆汁酸和免疫制度,“Kasper说,”HMS和Brigham和Wigham和Wigham和Wigham和Wigham Hounts医院的BlavaTnik学院的免疫学教授。“重要的是,我们的工作表明,思考某些人的工作是合理的肠道细菌作为调节疾病风险的一种方式。“
进一步探索
信阳松等。微生物胆汁酸代谢物调节肠道RORγ+调节T细胞稳态,自然(2019).DOI: 10.1038 / s41586 - 019 - 1865 - 0











用户评论