胸腺中肠道微生物与发育中的免疫细胞之间的新交流
新生儿在出生后立即面临独特的免疫挑战。当他们离开一个相对无菌的胎儿环境时,他们突然接触到大量的外来抗原,其主要负担是以新定植胃肠道的微生物群的形式出现的。到目前为止,这些迅速繁殖的外来入侵者是对新生儿免疫系统的最大威胁,新生儿免疫系统必须识别并将这些微生物分为良性、共生性或致病性。
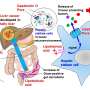
研究表明早期微生物与粘膜之间有效的“串扰”或交流免疫细胞对形成健康的微生物群落和促进机体功能健全至关重要吗免疫系统.参与粘膜免疫的免疫系统细胞在胸腺中发育,胸腺位于心脏上方的胸骨下。到目前为止,人们还不清楚肠道微生物是否影响老年人胸腺中这些细胞的发育早期的生活.
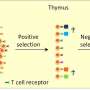
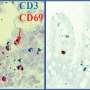
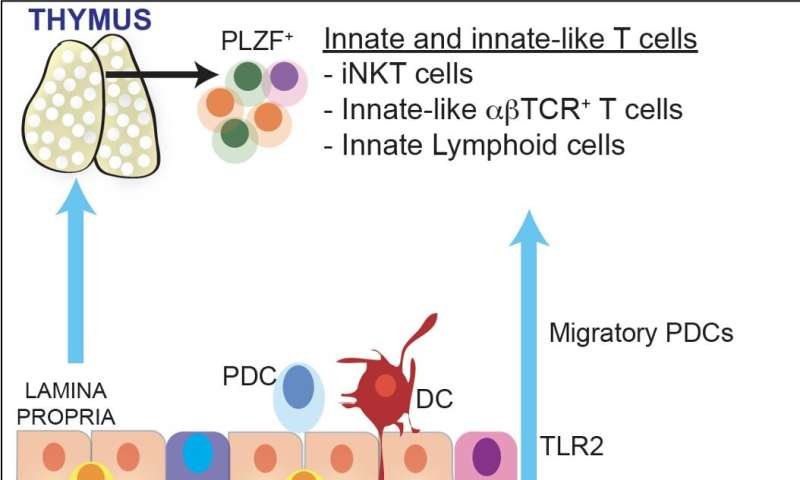
马萨诸塞州总医院粘膜与免疫生物学研究中心(MIBRC)的研究人员现在报告说,肠道微生物调节胸腺中特异性免疫细胞的发育,这些细胞在黏膜耐受中起着至关重要的作用。他们广泛研究的结果发表在美国国家科学院院刊这个星期。Nitya Jain博士和他的同事们将他们的研究集中在表达转录因子PLZF的免疫细胞子集上。这些细胞统称为先天性和类先天性淋巴细胞,通常在肠粘膜屏障界面起作用,并在黏膜部位提供免疫保护。
研究这些免疫细胞的发育肠道微生物在美国,研究人员进行了单殖民化无菌鼠用脆弱拟杆菌(Bacteroides fragilis)作为人类共生动物模型,证明了这种单一种类的细菌可以恢复幼鼠胸腺中PLZF+先天性和先天性样淋巴细胞的发育。在进一步的概念验证研究中,他们表明缺乏多糖a (PSA)表达的突变脆弱芽孢杆菌无法做到同样的事情,这表明特定的微生物抗原可以调节这种早期生命的发育过程。在缺乏Toll样受体2表达的突变小鼠中,这些细胞也出现了类似的缺陷。Toll样受体2是一种受体,可以识别细菌和细菌成分,包括脆弱芽孢杆菌PSA,从而启动宿主保护性免疫反应。
为了了解这种微生物信息是如何传递到发育中的胸腺细胞的,Jain的团队使用了一种新的小鼠模型来跟踪细胞从结肠到胸腺的迁移。这种照片转换策略是在Wellman光电医学中心的Guillermo“Gary”Tearney团队的帮助下开发的,并在2018年的《可视化实验杂志》上得到了强调。
研究人员发现,一类被称为浆细胞样树突状细胞(pDCs)的抗原递呈细胞被肠道微生物印迹,并在生命早期从肠道迁移到胸腺,以调节胸腺淋巴细胞的发育。Jain的团队第一次揭示了“肠道微生物和胸腺中发育细胞之间的一种新的交流,”Jain说。“它塑造了生命早期的免疫‘储备’,并影响了宿主在整个生命周期中对疾病的反应。”
婴儿发育的不平衡肠道微生物组被认为在生命后期的疾病发展中起着作用。例如,使用抗生素或饮食干扰婴儿时期的菌群,会增加过敏、哮喘和自身免疫性疾病(包括乳糜泻和炎症性肠病)的风险。Jain的研究小组为这一观察提供了一个机制基础。他们表明,在早期使用广谱抗生素治疗的小鼠中,胸腺PLZF+细胞没有有效发育,但在后期治疗的小鼠却得以存活。
Jain说:“在胸腺中发育中的免疫细胞特别容易受到微生物影响时,似乎有一个生命早期的时间窗口。”此外,研究表明,微生物诱导的胸腺先天和先天样细胞发育改变在生命早期持续到成年,导致实验性结肠炎的易感性增加。重要的是,PLZF+的转移可以减缓疾病的严重程度细胞来自早期发育正常菌群的小鼠,Jain说。她补充说:“这对治疗自身免疫性疾病(如IBD)的策略设计具有重要意义。我们的研究指向了一种以前未被探索的途径,可能被开发为一种过继细胞疗法。”
MIBRC主任Alessio Fasano医学博士指出,越来越多的证据表明,健康免疫状态的早期发展需要发育中的婴儿和他们的微生物群落之间的理想共生关系。“我们如何‘选择’理想的微生物群来教会我们的免疫系统保护我们而不是伤害我们,这仍然是一个大问号。尼提亚和她的团队第一次阐明了负责在人类宿主和微生物群之间建立健康关系的早期机制,”法萨诺说。
进一步探索