2020年1月21日报告
生命与铁下垂症的不断斗争
在自然过程中,多细胞生物经常需要消灭细胞。例如,在人类中,多余的尾巴、手指的蹼、错误思维培养的免疫细胞或结交不适当朋友的神经元都可能是健康的细胞,但需要给它们一个干净的出口。另一方面,由于突变或氧化损伤而被破坏的细胞对它们的邻居是一个直接的威胁,在它们优雅地退出之前,通常需要更激烈的鼓励。
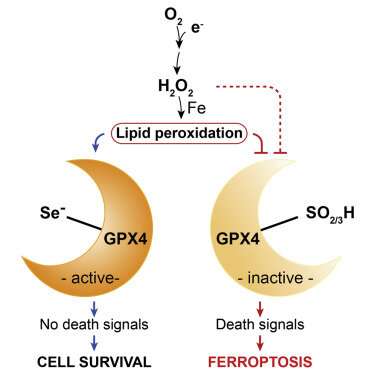
在每一种情况下,都有一种独特的程序性细胞死亡或细胞凋亡。铁掉落症是一种特别严重的形式,是在谷胱甘肽抗氧化系统的故障下引起的,该系统导致膜脂过氧化的广泛自发启动。其原因令人惊讶地单一:GPX4酶的供应无法满足需求。虽然GPX4只是人体庞大的8倍谷胱甘肽过氧化物酶防御武器库中的一个特定工具,但它是唯一配备巡逻细胞及其细胞器的磷脂边界的工具。
最近在自然马库斯·康拉德和德里克·普拉特的研究为我们理解铁下垂的化学过程,以及我们如何将其转化为我们的优势提供了坚实的基础。一方面,许多种类的肿瘤已被证明对铁下垂特别敏感。适应化疗并有转移风险的癌细胞特别依赖GPX4轴来生存。这使得它成为一个有吸引力的潜在药物靶点。
尽管研究表明铁螯合剂阻断了铁的作用,但作者指出,不同形式的铁是如何以及在哪里起作用的还不完全清楚。一条线索是,GPX4的一种特殊亚型在天然富铁线粒体的膜间空间中丰富。在铁下垂期间,线粒体由于嵴的破坏而收缩。这个过程可以被新的血脑屏障渗透分子抑制,比如liproxstatin-1如果被发现是安全的,最终可能会变成fda批准的医疗选择。
没有GPX4,生命是短暂的。移码突变产生过早截断GPX4蛋白的突变完全消除了它的功能,导致了一种被称为sedaghatian型脊椎干骺端发育不良(SSMD)的疾病。患有这种极其罕见疾病的婴儿通常活不过30天。Raghav Sanath大约一年半前出生,被发现患有SSMD。他的特异变异是常染色体隐性纯合突变c.647GPX4外显子6中的g>a。它位于染色体19p13.3(19-1106433),好奇的人可以在遗传术语中找到它的登录号(NM_001039848.2)。
这种CGC>CAC取代蛋白的作用是在蛋白的一个位置用组氨酸(H)替换正常的精氨酸(R)。在GPX4的简写形式中,这个位置编号为R152H,而在长写形式中,这个位置编号为R179H。在一些清单中,包括可切割的靶向序列,在这种情况下,它将被给出为R216H。虽然这种看似保守的一种基本氨基酸替换另一种基本氨基酸的效果可能不被认为是根本性突变,但它在GPX4中的影响是未知的,这是迫切需要生物物理建模的事情。在其他蛋白质中,H-for-R取代会产生增加pH敏感性甚至与癌变有关。
拉加夫的父亲萨纳特·拉梅什(Sanath Ramesh)是一名全职高级软件工程师,他现在把寻找治疗SSMD的方法作为自己的事业。他组建了一个专家团队,包括西雅图儿童医院的拉塞尔·萨尼托医生和圣地亚哥雷迪儿童医院的克里斯汀·威格比医生,以尽快探索治疗方法。他的近期目标是筹集300万美元来实施药物开发管道是他精心制定的。这将涉及到重新利用批准的药物,入围其他新的铁下垂修饰剂,并进行分析诊断生物标记疾病的发展和治疗萨纳特所有这些努力的基础是对GPX4疾病生物学的扭曲驱动。

在某种程度上,这是我们可以做到的。它始于一个简单的问题:是什么让GPX4如此重要?正如我们所看到的,GPX4将一种特殊的解毒能力带到一个特殊的地方(细胞膜),主要是一个特殊的细胞器(线粒体)。但这种独特的排毒能力是什么呢?简而言之,答案是硒——更具体地说,是GPX4 mRNA中氨基酸半胱氨酸的共翻译编码,通过劫持UGA终止密码子,在物种的进化过程中成为可能。虽然现在已知至少有25种人类蛋白质使用硒,但只有GPX4被发现满足明确定义的基本需求。
在所有高等生命形式的遗传密码的整个进化过程中,这一基本要求一直是一根刺。它可以总结如下:生死存亡紧密地依赖于大脑中的精英速度冠军的能力,即广泛的、快速发射的、parvalbumin阳性的加巴能中间神经元,以解毒其膜在高活性时期遭受的自由基损伤。如果没有这种安全机制,这些神经元的常规活动就会导致致命的癫痫发作。
马库斯·康拉德(Marcus Conrad)和其他人在过去几年里苦心研究Sec,得出的结论是,虽然硫能让你进门,但只有硒能让你出来。换句话说,当实验操纵小鼠在GPX4的活性位点保留良好的硫基半胱氨酸而不是Sec时,它们是出生时发育完全,但几周后就会死亡,因为它们开花的中间神经元很快就会被致命的铁下垂症击倒。这一过程可以比作在热力学和力学极限附近工作的喷气发动机。如果被推入陡坡,喷气式飞机可能会在一段时间内继续提供全部动力,但由于空速急剧下降的额外限制,它无法再摆脱自身的热量。
硒的原因吗?
从全球范围来看,硒远不如硫丰富,而且它的分布和生物利用度极不均匀。虽然梦想家可能会猜测其他星球上的潜在生命是否会使用与我们相同的遗传密码,但我认为真正的问题是硒在这些星球上的分布情况虚构的世界以及其生物体是否为其编码。将1 mol半胱氨酸插入生长中的蛋白质需要大约25 mol ATP。根据特定的物种,大多数不同的GPX亚型在它们的活性位点上与半胱氨酸共存。将硒添加到混合中需要更大的成本,更不用说重新调整遗传密码本身的巨大生存风险。为什么会有人想这么做?
硒明显大于硫。它的极化性也更强,外层价电子被束缚得更松散。因此,它是更好的亲核试剂活性氧比硫更快,但它缺乏π键的特性意味着它也更容易被还原。这些特性的组合意味着在自然界中用硒取代硫会导致含硒生物分子抵抗永久氧化。
与硫相比,硒蛋白的另一个考虑因素是其氧化还原电位较低。GPX4-Cys变体在其底物浓度超标的情况下经历过度氧化和不可逆失活。第二种哺乳动物硒蛋白TXNRD2也表现出这种过度氧化行为,这表明硒酸盐相对于硫酸盐的关键优势可以在抗过氧化性。
在康拉德的论文中,我们可以找到许多人生教训,其中包括一个残酷的现实,即我们对氧化过程的许多传统术语已经不再适用。例如,像“脂质过氧化”甚至“ROS”这样的术语通常是非常模糊的。过氧化是指脂质的过氧化作用或脂质氢过氧化物的形成。然而,在其通常用法中,该术语没有区分产物是通过自氧化自发形成的,还是通过酶催化过程形成的。
酶促脂质过氧化主要由脂氧合酶、非血红素铁双加氧酶和在较小程度上由环氧合酶进行。正如上述作者所指出的,很容易推测,GPX4中Sec的存在是进化中保留下来的,以适应可用于细胞信号转导目的而不影响细胞活力的细胞过氧化物。与高活性分子一样,例如超氧化物,代谢的潜在病理毒性副产物与必要的调节信号分子之间的区别通常是模糊的。
全基因组反向遗传筛选已经确定了激活铁下垂所需的另外两个基因。它们是酰基辅酶a合成酶(ACSL4)和磷脂酰胆碱酰基转移酶3 (LPCAT3)。更多的研究表明,凋亡诱导因子线粒体-2 (AIFM2)的过表达,一种能够从泛醌中回收泛醇的氧化还原酶,可以完全弥补GPX4的损失。此后,AIFM2被重新命名为铁下垂抑制蛋白-1 (FSP1)。根据Sanath的说法,FSP1似乎是一个有吸引力的靶向分子,但目前,还没有可行的方法可以安全地在人体中过度表达它。
萨纳斯组织了一次会议,将在今年4月举行,以便团结起来临床和研究工作一起在一个屋檐下。演讲嘉宾将包括铁ptosis的发现者Brett Stockwell和药物发现和“N-of-1”研究的真正先驱Ethan Perlstein。这一令人兴奋的新领域的最新进展可以在社交媒体#CureGPX4上追踪。
进一步探索
©2020科学BOB体育赌博X网络