流量下的受体:机械敏感的GPCR
LMU团队已经阐明了与重要生理过程调节的受体如何感知作用于血管的机械力。这些发现可能暗示了脉管系统疾病的新疗法。
流的流程血液通过静脉和动脉,在血管壁和立即下方的光滑肌肉上施加机械力。这些力在许多关键的生理过程中也起作用,包括对体内各种组织的血液供应自动调节。船只墙对此做出适当反应的能力的改变剪切应力还有助于诸如心脏肥大和子痫前期的疾病的发病机理,这种病在怀孕期间遭受了许多妇女的疾病。LMU的Walther Straub药理学和毒理学研究所的Michael Mederos教授,托马斯·古德曼教授和PD教授Ursula Storch博士现在已经确定了参与这些过程的一种传感器蛋白,并发现了它如何响应它机械力。该研究的结果出现在在线期刊上自然通讯。
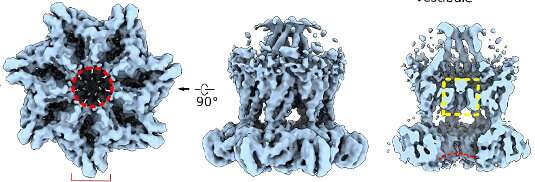
细胞与其环境之间的通信主要由专业介导受体蛋白嵌入细胞膜中。称为G蛋白偶联受体(GPCR)的家族构成了这些膜结合的受体的最大类。大多数GPCR是特定分子(配体)的传感器。配体的结合改变了蛋白质的构象,从而引发细胞内的反应。但是,该组的一些成员也对机械刺激做出反应。这项新研究的重点是一种称为组胺H1受体(H1R)的特定GPCR。该蛋白是迄今为止在血管排列的内皮细胞表面上发现的最丰富的GPCR。Mederos说:“在脉管系统中,该受体负责介导组胺引起的典型过敏反应。但是我们以前已经表明该蛋白质也对机械刺激有反应。”
现在,他和他的同事们仔细研究了该受体在血管系统中的作用。他们使用小鼠肠系膜动脉的孤立片段(为大部分胃肠道提供了血液),他们表明,在没有组胺的情况下,H1R确实被表面上的血液流过的剪切力激活内皮细胞。这些机械力类似地与分子配体的结合激活了H1R受体。这反过来触发了一系列反应,最终导致了血管,从而增加了组织的血液供应。
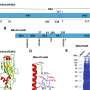
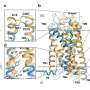
LMU小组证明H1R介导了这些生理反应,以响应剪切应力,研究了蛋白质机械敏感性的分子基础。GPCR部分由穿过膜的螺旋段组成,并用于连接其细胞内和细胞外域。大多数GPCR都有其中七个跨膜段。但是,H1R具有八个螺旋结构域,其中最后一个是细胞内的。Mederos解释说:“当我们去除该片段时,Helix 8,失去了受体的机械敏感性。”“相反,将此结构元素插入非机密敏感受体使他们能够对机械刺激做出反应。”
因此,研究人员假设剪切应力改变了螺旋的结构8。因此,H1R受体能够采用不同的结构构象,并触发不同的信号传导途径 - 依靠它是通过组胺或组胺等化学化合物的结合而激活的。由机械力。Mederos说:“将需要进一步的工作来确定膜的拉伸如何影响螺旋8。”
根据作者的说法,新发现是向前迈出的重要一步。梅德罗斯总结说:“更好地理解机械敏感性的基础将使我们进一步了解机械诱发的疾病的起源,并可以为预防和治疗这些疾病打开新方法。”
进一步探索