揭示聚集物劫持蛋白质的不寻常方式
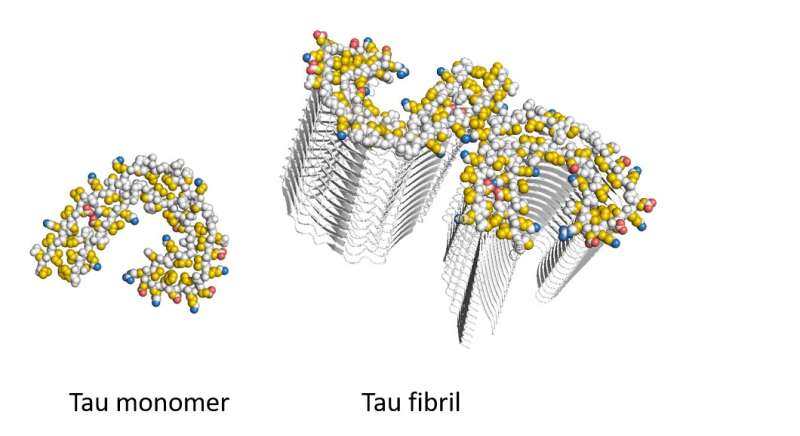
乌得勒支大学的科学家们发现了聚集物如何改变Tau蛋白的行为,已知Tau蛋白在阿尔茨海默病中发挥作用。在分子水平上,研究人员揭示了为什么某些蛋白质倾向于与Tau蛋白结合。关键在于这些蛋白质与Tau蛋白结合的不同寻常的方式。研究结果发表在自然通讯。
阿尔茨海默病的标志是大脑中Tau蛋白聚集引起的神经元死亡。关键是原纤维的形成:长针状Tau蛋白聚集物。然而,目前还不清楚为什么这些蛋白质聚集会杀死神经元。乌得勒支大学细胞蛋白化学部门的最后一位作者Stefan Rüdiger说:“没有治愈方法,仅仅是因为人们对这种疾病的分子基础知之甚少。”
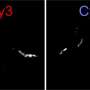
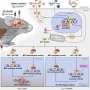
研究人员制造了阿尔茨海默氏症蛋白Tau的聚集物,并将它们暴露在含有大脑中所有蛋白质的混合物中。质谱分析显示,专门与Tau聚集物结合的蛋白质属于特定类别,已知在阿尔茨海默病的发展中发挥作用。对其组成的分析显示,它们通过一种不寻常的机制与Tau原纤维结合,即所谓的pi-堆叠,”Rüdiger解释道。
叠加
这种薄饼状的Tau原纤维堆积促使蛋白质与Tau原纤维结合。在出版物中,研究人员透露分子水平上蛋白质聚集背后的机制以及这是如何影响细胞过程。这是针对疾病根源的重要的第一步。
“所有由蛋白质聚集引起的疾病——帕金森氏症、亨廷顿氏症、阿尔茨海默氏症——都缺乏对这种疾病的基本了解,”Rüdiger说。“如果我们希望能够治疗这种疾病,就必须了解这种疾病。”
进一步探索