CRISPR有助于识别潜在的阿尔茨海默病相关蛋白

东京大学的专家们在导致阿尔茨海默病的途径中发现了一种新的蛋白质。研究人员使用CRISPR/Cas9的“分子剪刀”来寻找与神经退行性疾病相关的新基因。
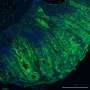
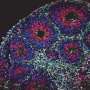
阿尔茨海默病的确切原因尚不清楚,但最受支持的理论之一集中在一种名为β淀粉样蛋白。聚集或聚集在一起,以及两种蛋白质的沉积,淀粉样蛋白在病人的大脑中,β和tau是阿尔茨海默病的标志。
CRISPR/Cas9允许科学家对内部的DNA进行特定的改变细胞。研究人员使用CRISPR/Cas9系统删除培养皿中生长的小鼠细胞中的单个基因,然后测量细胞产生的淀粉样蛋白的数量。
“我们相信这是第一次有人使用CRISPR/Cas9基因筛选技术来寻找淀粉样蛋白产生的变化,”该研究的第一作者之一堀由纪子说研究论文发表在美国实验生物学学会联合会杂志东京大学讲师。
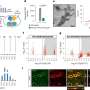
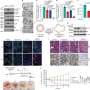
研究人员共测试了19150个基因对淀粉样蛋白水平的影响,并排除了除钙和整合素结合蛋白1 (CIB1)外的所有基因。
没有功能CIB1基因的细胞产生异常高水平的淀粉样蛋白。
东京大学(University of Tokyo)病理生物化学专家、进行这项研究的研究实验室负责人富田泰(TaisukeTomita)教授说:“没有人知道为什么β -淀粉样蛋白会在阿尔茨海默病患者的大脑中沉积,但我们认为这一过程的起点可能是CIB1。”
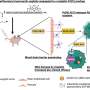
在健康细胞中,CIB1并不直接参与淀粉样蛋白的加工,但CIB1附着在一种叫做γ分泌酶细胞内和细胞膜上都有。在没有CIB1的细胞中,γ分泌酶在细胞内停留的时间更长,不会移动到细胞膜上。
淀粉样蛋白在形成最终形态之前要经历多个步骤的修剪过程。在健康条件下,分泌酶处理β淀粉样蛋白前体,产生最终的β淀粉样蛋白。这种加工活动发生在细胞的内部隔室,然后分泌酶移动到细胞的表面膜。
在小鼠细胞中进行的其他实验使研究人员能够追踪CIB1如何调节γ分泌酶。在健康的细胞例如,CIB1不直接参与γ分泌酶加工β淀粉样蛋白的活性,但CIB1在细胞内腔室和细胞膜表面附着在γ分泌酶上。
在没有CIB1的细胞中,分泌酶停留在细胞内部的隔室中,不会移动到细胞膜表面。在内部隔室中停留的时间越长,伽马分泌酶就会产生更多的淀粉样蛋白。
Hori说:“我们的研究结果表明,调节CIB1和γ分泌酶的位置可能是阿尔茨海默病治疗的新目标。”
被他们的细胞实验所说服,Tomita的研究小组决定直接寻找阿尔茨海默病患者大脑中CIB1含量的变化。他们检查的病人数据来自美国的一个长期项目,即宗教秩序研究、记忆和衰老项目(ROSMAP)。该项目跟踪志愿者的健康状况,这些志愿者都是专业的宗教领袖(修女、牧师、兄弟),并同意在死后捐献自己的器官用于研究。
被诊断患有早期阿尔茨海默病的人大脑中的CIB1水平低于健康人。矛盾的是,被诊断为阿尔茨海默病晚期的人的CIB1水平高于健康水平。
“我们不能确定为什么CIB1在晚期阿尔茨海默病中增加。重要的是,在阿尔茨海默病的早期和晚期,CIB1的调节都出现了异常。”
未来的研究项目将揭示CIB1在导致不健康的β淀粉样蛋白水平和阿尔茨海默病的细胞过程中所起作用的更多细节。研究人员还计划使用他们的CRISPR/Cas9筛选技术来寻找影响其他主要阿尔茨海默病的新基因疾病蛋白质τ。