了解tau蛋白如何在神经元之间移动,可以为神经退行性疾病的治疗提供见解
在抗击额颞叶痴呆、阿尔茨海默病和慢性创伤性脑病等神经退行性疾病时,tau蛋白是罪魁祸首。tau在我们的脑细胞中大量存在,通常是一个团队成员——它维持神经元内的结构和稳定,并帮助将营养物质从细胞的一个部分运输到另一个部分。
当错折时,所有这些都改变了。它变得粘稠且不溶,聚集并在神经元内形成神经纤维缠结,破坏它们的功能并最终杀死它们。更糟糕的是,它可能只需要一个细胞中相对较少的错误折叠tau蛋白,就能让它的邻居出现故障,死亡大脑细胞.
加州大学圣巴巴拉分校神经科学家肯尼斯·s·科西克说:“这种异常形式的tau蛋白开始从一个细胞扩散到另一个细胞。”“这让人想起生物学中已知的一个严重问题,叫做朊病毒疾病,比如疯牛病。”
重要的是,不像true朊病毒疾病这种病毒是通过接触受感染的组织或体液传播的,类似朊病毒的疾病如额颞叶痴呆其他牛头病不具有传染性——它们不会在人与人之间传播,也不会通过接触受感染的组织而传播。然而,这种复制非常熟悉:一个错误折叠的tau蛋白蛋白质离开一个细胞,被一个正常的相邻细胞占据。Kosik解释说,然后它在细胞中充当模板,随后产生错误折叠的tau。一遍又一遍地细胞产生和分泌有毒的山寨版本的tau蛋白,直到整个大脑区域受到影响,随着时间的推移,会剥夺一个人的认知和身体功能。
如果疫情能被控制呢?如果及早发现,控制病理性tau蛋白的增殖可以阻止神经退行性疾病的进展,并让患者有机会过上正常的生活。但为了做到这一点,科学家们首先必须了解蛋白质是如何传播的。
在杂志上发表的一篇论文中自然Kosik和他的团队已经发现了tau在神经元之间传播的这样一种机制。它不仅揭示了神经退行性疾病中广泛研究但知之甚少的tau传播,还暗示了一种控制病理性tau传播的方法。
Kosik是加州大学圣巴巴拉分校分子、细胞和发育生物学系神经科学研究的哈里曼教授,他说:“tau在细胞间传递的机制的发现,为设计可以防止tau扩散的分子提供了一种深层结构方法。”
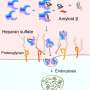
事实证明,在这种吸收和传播机制中,主要的参与者是低密度脂蛋白这种蛋白质被称为LRP1(低密度脂蛋白受体相关蛋白1)。它位于脑细胞细胞膜上,参与了几个生物过程,其中包括帮助神经元吸收胆固醇,胆固醇是细胞结构的一部分。
研究人员发现,LRP1从细胞逃逸到细胞外空间后,会在邻近细胞中吸收tau蛋白。作为几种低密度脂蛋白受体之一,LRP1通过消除过程被挑选出来:通过CRISPRi技术系统地抑制该家族每个成员的表达,并将它们暴露于tau,研究人员确定LRP1的遗传沉默有效地抑制了tau的摄取。
Kosik说:“这种蛋白质本身就很有趣,因为它有点像细胞外的垃圾桶。”“它不只是接收tau蛋白;如果有其他垃圾,它也会把它们捡起来。”
但是LRP1识别的tau蛋白是什么呢?深入挖掘后,科学家们发现了赖氨酸上的一段氨基酸τ蛋白就像秘密握手一样打开了通往神经元的大门。
“所以这些都是线索,”科西克说。
阻止传播
“由于我们的细胞工作表明tau可以与细胞表面受体LRP1相互作用,这导致了tau的内吞作用,我们的假设是,如果我们减少小鼠中LRP1的表达,我们就应该降低相邻神经元吸收tau的能力,”该研究的主要作者,博士后研究员Jennifer Rauch解释说。
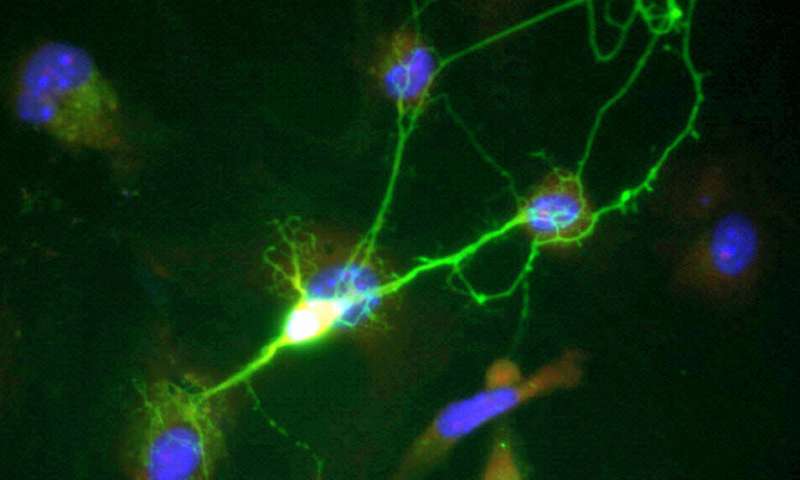
为了支持他们的体外研究,研究人员将tau蛋白注射到小鼠体内,其中一些小鼠的LRP1基因被LRP1抑制RNA下调。tau蛋白被一小串氨基酸与一种绿色荧光蛋白结合,以帮助科学家在注射后观察tau蛋白。
Kosik解释说:“一旦这种结构进入细胞,氨基酸连接器就会被切断,荧光蛋白和tau就会彼此分离。”他们发现,在LRP1正常的动物中,tau蛋白有扩散的趋势;在lrp1被抑制的小鼠中,这种蛋白质保持不变,大大降低了它被其他正常神经元吸收和复制的可能性。“这是我们第一次看到tau蛋白传播的完全消失,”他说。
“当我们减少LRP1的表达时,我们看到tau蛋白在动物体内的传播减少,”Rauch说,他之前曾研究硫酸肝素蛋白多糖对tau蛋白摄取的作用。她指出,最近的一项研究包括Kosik和研究生Juliana Acost-Uribe,该研究描述了一名患有严重的早发性阿尔茨海默氏症基因形式的患者,但由于第二次突变似乎阻止了tau蛋白的传播,因此幸免于这种疾病。该团队渴望了解该患者的第二次突变如何通过与LRP1相互作用来阻止tau蛋白的传播。
“接下来,”Rauch说,“我们将专注于试图破译tau-LRP1相互作用的界面,并了解这是否可能是一个药物靶点。”