当星形胶质细胞攻击:干细胞模型显示神经退行性变的可能机制
今天发表的一项新研究神经元由纽约干细胞基金会(NYSCF)研究所的Valentina Fossati博士领导,从干细胞中创造了星形胶质细胞——大脑中不可或缺的支持细胞,并表明在类似疾病的环境中,这些正常有益的细胞可以变成神经元杀手。
“我们现在可以创造了干细胞NYSCF首席执行官苏珊·l·所罗门(Susan L. Solomon)说:“我们可以从任何个人身上看到星形胶质细胞在多发性硬化症、帕金森症和阿尔茨海默症等疾病中发挥的作用。”“这将为神经退行性变的破坏性过程提供新的线索,为这一不断增长的患者群体提供有效的治疗方法。”
从干细胞中创造星形胶质细胞
星形胶质细胞,星形细胞,占中枢神经系统细胞的一半以上,属于一类大脑一种叫做神经胶质的细胞为神经元在大脑里。星形胶质细胞有助于代谢过程,调节脑回路的连通性,参与炎症信号,并帮助调节血脑屏障的血液流动,以及其他功能。它们是大脑功能的重要组成部分,但在研究和研究中经常被忽视药物开发尽管最近越来越多的证据表明,它们在很多案件中都存在神经系统疾病.
大多数关于星形胶质细胞的研究都是在小鼠模型上进行的,但已经表明小鼠星形胶质细胞与人类星形胶质细胞并不完全相同。这意味着人类的许多方面星形胶质细胞功能,包括一些可能与疾病相关的行为,并没有被小鼠模型完全捕捉到。
“该领域需要一种可靠的方法来从干细胞中制造人类星形胶质细胞,这样我们就可以更好地研究它们是如何发挥作用的神经退行性疾病NYSCF研究所的高级研究员Fossati博士解释道。“以前,失败的药物不是专门针对星形胶质细胞的。现在,针对星形胶质细胞故障的药物可以通过患者细胞来识别。”
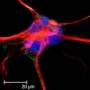
福萨蒂博士的团队基于他们之前发表的将干细胞转化为神经胶质细胞(如小胶质细胞(大脑的免疫细胞)和少突胶质细胞(帮助神经元通信的细胞)的方案,识别出一种蛋白标记CD49f,这种标记在星形胶质细胞中表达,可用于将它们从实验室培养皿或人脑中的混合细胞群中分离出来,从而促进下游研究。
福萨提博士说:“我们很兴奋地看到,我们用CD49f分离的干细胞来源的星形胶质细胞表现得和典型的星形胶质细胞一样:它们吸收谷氨酸,对炎症做出反应,参与吞噬作用——就像‘细胞吞噬’——并鼓励神经元中成熟的放电模式和连接。”
研究小组还证实,CD49f存在于人脑组织中的星形胶质细胞中。
“我们研究了来自健康捐赠者和阿尔茨海默病患者的人脑组织样本,发现这些星形胶质细胞也表达cd49f,这表明这种蛋白质是健康和疾病中星形胶质细胞身份的可靠指标。”
当星形胶质细胞失控
用干细胞制造功能性星形胶质细胞细胞之后,研究小组将注意力转向了这些星形胶质细胞在疾病中是如何开始失常的。
纽约大学(NYU)的Shane Liddelow博士是这项研究的合作者,他最近的工作发现星形胶质细胞会“失控”,对它们通常支持的神经元产生毒性。
纽约大学格罗斯曼医学院神经科学、生理学和眼科学助理教授Liddelow博士解释说:“我们在小鼠身上观察到,炎症环境中的星形胶质细胞处于反应状态,实际上是攻击神经元,而不是支持神经元。”“我们在神经退行性疾病患者的大脑中发现了反应性星形胶质细胞的证据,但没有人类干细胞模型,就不可能弄清楚它们是如何产生的,以及它们在患者大脑中的作用。”
福萨蒂博士试图利用她的人类干细胞模型来确定利德罗博士在小鼠身上观察到的情况是否也会发生在人类身上。她的团队将健康的干细胞来源的星形胶质细胞暴露在炎症中——基本上是模仿神经退行性疾病中的大脑环境——收集它们的副产品,然后将这些分泌物暴露在健康的神经元中。
福萨蒂博士说:“我们在培养皿中看到的情况证实了利德罗博士在老鼠身上看到的情况:神经元开始死亡。”“在人类疾病模型中观察这种‘流氓星形胶质细胞’现象,表明它可能发生在实际患者身上,并为干预这一过程的新疗法打开了大门。”
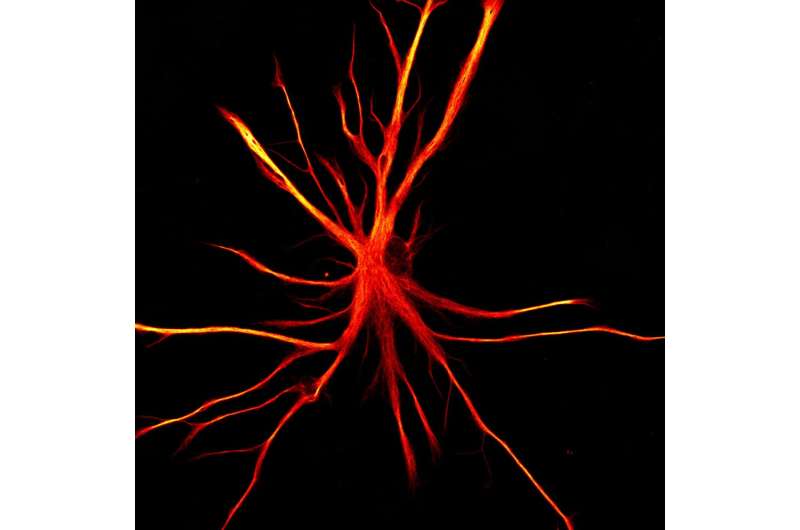
研究小组还发现,暴露在炎症中的干细胞来源的星形胶质细胞失去了典型的星形胶质细胞功能:它们不能很好地支持神经元成熟或放电,而且它们不能摄取那么多的谷氨酸盐。它们的形态也发生了变化,失去了它们特有的“长臂”,变成了更狭窄的星形。
Fossati博士指出:“除了分泌一种杀死神经元的毒素外,我们还发现,在类似疾病的环境中,干细胞衍生的星形胶质细胞根本不能完成它们的典型工作,这可能导致神经元功能障碍。”“例如,由于它们不能正确地吸收谷氨酸,太多的谷氨酸可能会留在神经元周围,这可能会导致神经元萎缩,这是我们可能在新疗法中针对的问题。”
总之,这些发现开辟了令人兴奋的新研究途径,并为研究人员提供了一个探索机制的新系统疾病.
“我期待着使用我们的新系统来进一步探索阿尔茨海默氏症、多发性硬化症、帕金森症和其他疾病中星形胶质细胞功能的复杂性,”Fossati博士说。“我们已经看到了可能解释神经退行性变如何发生的有趣行为,我希望这项工作将为我们指出这些患者的新治疗机会。”
更多信息:神经元(2020)。DOI: 10.1016 / j.neuron.2020.05.014