对蛋白质错误折叠的深入研究可以开辟治疗帕金森病的新方法
研究人员发现了蛋白质α -突触核蛋白的结构与其错误折叠和聚集的可能性之间的联系。
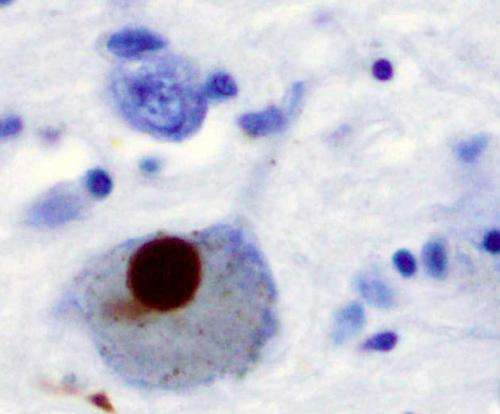
α -突触核蛋白聚集物是神经退行性疾病的标志,如帕金森病。他们的研究结果今天发表在自然通讯,在帕金森病的治疗中发现潜在的新治疗靶点。
的人类的大脑含有一种叫做突触核蛋白(aSyn)的蛋白质,它主要存在于神经元尖端的突触前末梢结构中。在帕金森氏症和其他一些神经退行性疾病中,aSyn蛋白变得不稳定,错误折叠并聚集成不溶性原纤维,这是该疾病的一个标志。目前,我们不明白为什么aSyn错误折叠或如何阻止它这样做。这意味着像帕金森氏症这样的疾病仍然无法治愈。在英国,每350个成年人中就有一人患有帕金森氏症。
剑桥大学化学工程与生物技术系的Amberley Stephens博士是该研究论文的第一合著者,他说:“我们想了解为什么通常健康的、单体的、可溶性的aSyn突然开始错误折叠。”
“理解错误折叠途径中的这些初始步骤意味着我们可以确定新的治疗靶点来治疗异步错误折叠障碍。然而,这是非常困难的,因为aSyn没有真正的结构,而是以许多高度动态的中间结构或构象存在。”
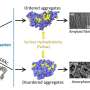
为了了解如何阻止aSyn在神经元中聚集,研究人员必须研究aSyn在容易聚集时形成的初始构象单体,与不容易聚集时形成的单体形成的构象进行比较。研究人员通过添加一种已知的聚集诱导离子钙,故意使aSyn聚合更快,以研究单体动态结构中的这些微小差异。
该团队使用了一系列尖端分析技术,研究了当aSyn处于聚合倾向或非聚合倾向状态时,各种分子内相互作用的情况。
“在这项研究中,我们使用了氢-氘交换质谱分析这是一种功能强大、用途广泛的生物物理技术,可以提供蛋白质(如aSyn)的结构和动力学信息。简单地说,我们正在捕捉蛋白质在不同环境中姿势的差异。我们在埃克塞特大学的合作者一直在致力于仪器的开发,这样我们就能够检测到蛋白质种群之间越来越小的差异——这对aSyn这样的柔性蛋白质尤其重要,”来自剑桥大学化学工程和生物技术系的研究论文的第一合著者Maria Zacharopoulou说。
他们观察到特定的区域被称为aSyn的n端,它位于蛋白质序列的开始,当添加聚集诱导离子钙时,它变得更加暴露,蛋白质在结构上开放。此外,暴露的程度与aSyn聚集的速度相关,而更封闭的结构没有聚集。
通过使用氢-氘交换质谱,研究人员可以确定蛋白质序列的修改,或导致早发性帕金森病的遗传突变的存在,导致动态aSyn单体结构的变化。这项研究为帕金森症带来了新的见解疾病在反应过程的最开始,从单体到聚集体发生转变的时候。
这一发现可能会导致新的治疗靶点,如稳定aSyn的封闭结构蛋白质可能会阻止它聚集。接下来的步骤将涉及从动态单体结构池中分离特定的聚集倾向和非聚集倾向结构,以设计治疗方法,在aSyn单体开始错误折叠之前稳定或中和它。
更多信息:Amberley D. Stephens等,α -突触核蛋白n端暴露程度决定其聚集倾向,自然通讯(2020)。DOI: 10.1038 / s41467 - 020 - 16564 - 3