新型冠状病毒肺炎研究性疫苗三期临床试验开始
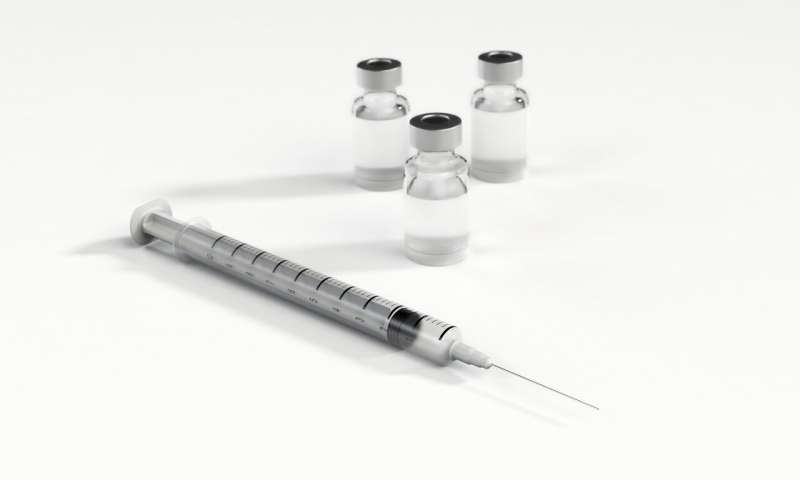
一项旨在评估一种研究性疫苗是否可以预防成人有症状的2019冠状病毒病(COVID-19)的三期临床试验已经开始。这种名为mRNA-1273的疫苗是由马萨诸塞州剑桥市的生物技术公司Moderna, Inc.和美国国立卫生研究院下属的国家过敏和传染病研究所(NIAID)联合开发的。该试验将在美国临床研究地点进行,预计将招募约3万名没有感染COVID-19的成年志愿者。
“虽然戴口罩、保持身体距离以及对感染者和接触者进行适当隔离和隔离可以帮助我们减轻SARS-CoV-2的传播,但我们迫切需要一种安全有效的预防措施疫苗最终控制这场大流行,”NIAID主任安东尼·s·福奇博士说早期临床试验结果表明,研究性mRNA-1273疫苗是安全的,具有免疫原性,支持启动三期临床试验。这项科学严谨、随机、安慰剂对照试验的目的是确定疫苗是否可以预防COVID-19,以及这种保护可以持续多久。”
Moderna作为监管赞助商领导该试验,并为试验提供研究性疫苗。美国卫生与公众服务部负责防范和应对的助理部长办公室的生物医学高级研究与发展管理局(BARDA)和NIAID正在为该试验提供资金支持。该疫苗有效性试验是在“曲速行动”(Operation Warp Speed)下实施的首个试验。“曲速行动”是由美国卫生与公众服务部领导的多机构合作项目,旨在加速COVID-19医疗对策的开发、制造和分发。
“到2020年底分发安全有效的疫苗是一个艰巨的目标,但这对美国人民来说是正确的目标,”国家卫生研究院主任弗朗西斯·s·柯林斯博士说。“在创纪录的时间内启动这项三期试验,同时保持最严格的安全措施,展示了美国的独创性,以及当利益相关者以无懈可击的客观态度朝着共同目标聚集在一起时可以做些什么。”
美国国立卫生研究院冠状病毒预防网络(CoVPN)将参与这项试验。该网络汇集了现有niaid支持的临床研究网络的专业知识。mRNA-1273候选疫苗将在美国约89个临床研究地点进行测试,其中24个是CoVPN的一部分。调查人员将使用公共卫生数据和发病率轨迹建模来确定持续的高发地区和新兴热点地区,因此可以优先选择这些地点附近的地点进行登记。
美国卫生与公众服务部部长亚历克斯·阿扎尔说:“由于特朗普总统的领导和美国科学家的辛勤工作,由NIH和Moderna开发的研究性疫苗以创纪录的速度进入了三期试验。”“曲速行动正在支持一个疫苗组合,如NIH/Moderna候选疫苗,因此,如果结果临床试验符合FDA的黄金标准,这些产品可以到达美国人没有一天的延迟。”
NIAID的科学家开发了稳定的SARS-CoV-2 spike免疫原(S-2P)。SARS-CoV-2是导致COVID-19的病毒;其表面的刺突蛋白便于进入细胞。Moderna的mRNA-1273使用信使RNA (mRNA)传递平台来编码S-2P免疫原。这种试验性疫苗引导人体细胞表达刺突蛋白,从而引发广泛的免疫反应。一期临床试验发现,候选疫苗是安全的,通常耐受性良好,能够诱导具有高水平病毒中和活性的抗体。Moderna于2020年5月启动了疫苗的二期试验。
Hana M. El Sahly,医学博士,休斯顿贝勒医学院niaid资助的传染病临床研究联盟站点的首席研究员;Lindsey R. Baden,医学博士,波士顿布里格姆妇女医院niaid资助的哈佛HIV疫苗临床试验组的首席研究员;Brandon Essink,医学博士,子午线临床研究的首席研究员和医学主任,将担任mRNA-1273三期试验的联合首席研究员。
作为加速COVID-19治疗干预措施和疫苗(ACTIV)公私伙伴关系的一部分,NIH和其他卫生与公众服务部机构和政府合作伙伴与学术界、慈善组织和众多生物制药公司的代表合作,就试验方案设计和终点提出建议,以确保多种疫苗功效的协调方法试用.
该试验旨在评估mRNA-1273的安全性,并确定疫苗是否可以在两剂疫苗后预防症状性COVID-19。作为次要目标,该试验还旨在研究该疫苗是否能预防有或无疾病症状的严重COVID-19或实验室确认的SARS-CoV-2感染。该试验还试图回答疫苗是否可以预防COVID-19导致的死亡,以及是否只需一剂疫苗就可以预防有症状的COVID-19。
试验志愿者将接受两次肌肉注射,间隔约28天。参与者将被随机分配为1:1,接受两次100微克(mcg)的mRNA-1273注射或两次盐水安慰剂注射。试验是盲法的,因此研究人员和参与者不知道谁被分配到哪个组。
志愿者必须提供知情同意才能参加试验。他们将被要求提供一个鼻咽拭子和一个血液样本在每次疫苗接种后和第二次疫苗接种后两年的指定时间点进行初次筛查访问和额外的血液样本。科学家们将在实验室检查血液样本,以检测和量化对SARS-CoV-2的免疫反应。
调查人员将密切监控参与者的安全。他们将在每次接种疫苗后打电话给参与者,讨论任何症状,并将为参与者提供日记,记录症状和温度计读数。
如果参与者被怀疑感染了COVID-19,参与者将被要求在72小时内提供鼻拭子进行检测。如果测试结果为SARS-CoV-2感染阳性,参与者将受到密切关注,如果症状恶化,将被转诊就医。参与者将被要求通过解决方案提供每日症状评估,并定期采集唾液样本,以便研究人员检测SARS-CoV-2感染。
研究调查人员将定期审查试验安全性数据。一个独立的数据和安全监测委员会(DSMB)将在预定的数据审查会议上审查盲法和非盲法数据,包括两组的安全数据和COVID-19病例。
进一步探索













用户评论