寻求艾滋病毒疫苗

艾滋病规划署估计,3800万人目前患有人类免疫缺陷病毒(HIV)感染。组合抗逆转录病毒治疗在储蓄生活中取得了巨大成功,但也与众多医学和公共卫生挑战有关。疫苗接种仍然是对世界各地的艾滋病毒感染的最佳和最具成本效益的选择。来自牛津大学,英国和熊本大学,日本,设计疫苗和协调临床计划的临床计划,测试了他的团队在英国,欧洲,美国和非洲开发的最先进的疫苗候选人。
结束艾滋病疫苗接种
人类免疫缺陷病毒(HIV)1型占全世界所有艾滋病毒感染的95%,负责全球艾滋病毒大流行。如果未经处理过的,艾滋病毒感染的患者会发育获得的免疫缺陷综合征 - 更好地称为艾滋病 - 表现为免疫系统的渐进性失败。结果,患者最终屈服于机会主义感染。组合抗逆转录病毒治疗(推车)改变了艾滋病毒的人们的生活,并显着降低了艾滋病相关的死亡率和艾滋病毒的途径。
不幸的是,为每个需要它面临许多障碍的人提供推车,特别是在低收入和中等收入国家。治疗的成本,复杂性,定期监测患者,耐药威胁,副作用,社会耻辱和使用推车,以预防艾滋病毒感染(或预曝光预防),进一步延伸推车供应,制作推车是一个次优的治疗和一个不太可能的独立工具,以结束艾滋病病毒疫情。因此,有效疫苗迫切需要预防和治疗艾滋病毒。
Tomáš Hanke教授和他在英国牛津大学Jenner研究所的团队,以及他们在日本熊本大学人类逆转录病毒感染联合研究中心的合作者,正在研究T细胞对艾滋病毒的反应,为疫苗的开发提供信息。此外,汉克教授在几个全球地点监督着他的领先t细胞疫苗候选对象在健康和艾滋病毒阳性人群中的实验医学试验,并与著名大学和组织合作,如国际艾滋病疫苗倡议,西班牙IrsiCaixa艾滋病研究所- hivacat,伦敦帝国理工学院,肯尼亚艾滋病疫苗倡议-临床研究所和国家过敏和传染病研究所。他还协调“全球相关艾滋病疫苗欧洲-非洲试验伙伴关系”联盟(缩写为GREAT),该联盟在东部和南部非洲建立研究能力并测试候选疫苗,他还是2020年欧洲艾滋病疫苗倡议的主要调查员之一。
理性的迭代发育
当今的艾滋病疫苗研究大多集中于抗体介导的免疫,这种免疫可以中和游离细胞的病毒,通常涉及到将人暴露于外部的艾滋病病毒刺突。然而,为了控制艾滋病毒,抗体可能需要辅以t细胞反应,这也是汉克教授研究的重点。毫无疑问,T细胞在抗艾滋病毒免疫中发挥着重要作用,CD8 T细胞被称为“杀手细胞”,直接杀死病毒感染的细胞,病毒工厂,而CD4 T细胞或“辅助细胞”协助和协调抗体和T细胞诱导。汉克教授解释说:“关键是诱导能够减缓或阻止HIV的保护性杀伤T细胞,而不是任何一种。”
汉克教授和他的同事发表的第一个临床测试疫苗被称为艾滋病毒关系。它来自非洲思潮的一种艾滋病毒,在十几种临床试验中进行了测试。在该领域对艾滋病毒的巨大变革能力的全面欣赏,汉克教授通过将疫苗引发的T细胞聚焦在艾滋病毒的功能保守区域,这对大多数HIV菌株常见并且对病毒存活至关重要。如果成功,这种疫苗可以在所有全球区域普遍部署。
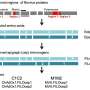
原型保守的免疫原被称为HIV conv(强调除了一致序列之外的保守),并将高度保守的HIV区域组装成一个嵌合蛋白,改变了全球主要HIV毒株。这种疫苗在最初的小型临床试验中显示出令人鼓舞的结果,并为第二代保守疫苗的设计提供了信息,称为HIVconsvX。艾滋病毒consvx的显著改进包括使用生物信息学重新定义保守区域,并通过使用所谓的"马赛克"设计增加疫苗与全球艾滋病毒变体的匹配度。2019年,艾滋病毒consvx疫苗进入临床评估,进一步的试验正在进行中。
疫苗载体的重要性
疫苗引发的T细胞应答的质量受到HIV免疫原的影响力强烈影响。最优先事项是Hanke和Hanke教授,他的同事测试所有潜在的疫苗载体,旨在首先在小鼠和猕猴中进行人类使用。组合进步的三种最有前途的方式人类研究这些病毒包括:1)质粒DNA; 2)黑猩猩源的工程腺病毒(其亲本会在猴子身上引起一种普通的感冒样疾病);3)痘病毒修饰的痘苗病毒安卡拉(MVA),这是一种减毒的天花疫苗,在根除天花运动中许多人安全地使用。这三种疫苗没有一种具有复制能力,可以在被接种者体内生长或传播到环境中;他们是安全的。
HIVA疫苗是由DNA和MVA的组合传递的,主要由于DNA引物效率低下,只能诱导较弱的t细胞反应。通过添加黑猩猩腺病毒,hiv疫苗对T细胞的诱导得到了极大的改善。然而,没有DNA的腺病毒- mva组合与三种载体结合效果一样好,因此被选择进行进一步研究。
艾滋病疫苗接种诱导的强T细胞能够识别艾滋病病毒的多个位点。在肯尼亚内罗毕的艾滋病毒阴性志愿者中,疫苗诱导的T细胞在实验室条件下能够对艾滋病毒产生广泛的交叉支链抑制。艾滋病毒疫苗也在对早期治疗的艾滋病毒阳性个体进行的“踢杀”研究中进行了测试。在感染过程中,艾滋病毒融入宿主染色体,停止表达其蛋白质(“睡着”),对免疫系统变得不可见,但定期重新激活。这意味着,要将HIV病毒从体内清除,所有熟睡中的HIV病毒首先需要被唤醒,或者被“踢醒”,然后才能被疫苗诱导的杀伤T细胞杀死。
在西班牙巴塞罗那的一项小型飞行员“踢腿”学习中,艾滋病毒杆菌疫苗与艾滋病毒症疫苗一起提供了持续抑制的静脉复制在停止后持续抑制。虽然是边缘的结果,但非常令人鼓舞,并有助于进一步测试与这些疫苗为艾滋病毒治愈的疫苗的“踢腿”策略。
了解HIV变异性的后果
成功的疫苗需要引发能够达到艾滋病毒感染细胞并杀死它们以阻止病毒生长的杀手T细胞。为了安全有效,杀手T细胞攻击必须从第一次暴露于病毒的第一次暴露,必须足够具体和有效地靶向艾滋病毒的脆弱部分。然而,艾滋病毒是极大的变化,这使得它非常擅长避免T细胞攻击和逃逸。人们的遗传化妆有很多支持证据,杀手T细胞靶向和艾滋病毒逃生的艾滋病毒遗址是个人对抗艾滋病毒和科学家需要详细了解这些流程的主要决定因素。
一些T细胞反应比其他T细胞应答更好。过去,试图了解艾滋病毒的艾滋病病毒毒病患者的目标常常看待对整个病毒和/或全长病毒蛋白作为单位的反应。这会模糊分析,因为在每种蛋白质内都有稳定和可变的区域,并且这些不均匀的保护性。汉克教授的战略利用稳定,因此在HIV蛋白质上的脆弱部件。
汉克教授在熊本和东京大学的同事们的研究支持了这一观点。从未接受过任何cART的艾滋病毒感染者,如果他们的目标是疫苗中使用的相同区域,就能更好地控制艾滋病毒,并且更健康(血液中有更多的CD4细胞)。这是支持这种疫苗方法的重要观察结果。
寻求改进
尽管汉克教授的策略是合理的,而且到目前为止得到了良好的实验结果的支持,但在研制有效的t细胞疫苗的道路上仍然存在许多挑战。
为了高效,T细胞应答必须在艾滋病毒暴露/再激活时,快速到达患者体内的艾滋病毒生长位点,杀死感染的细胞并产生抗HIV化学品,有足够的数字,并识别多个弱势区域同时让逃生困难。如果这些T细胞性质的任何一个方面是次优,则疫苗可能会失败。
Hanke教授和他的同事研究了由HIV感染和疫苗接种引起的t细胞反应,以进一步完善疫苗免疫原及其载体传递。在临床前调查和人体试验中测试了新的、有时小但重要的逐步改进。汉克教授说:“人类数据是迭代改进的最佳依据,而人类数据是最终至关重要的唯一物种。”
最后,新生儿、儿童和青少年中的一些人是围产期感染艾滋病毒的,即通过母婴传播,或通过母乳接触艾滋病毒的婴儿,由于他们年纪小,而且如果在出生后不久就接受治疗,免疫系统相对保留,因此在某种程度上仍然是独特的群体。迄今为止,已经进行了数百次人体艾滋病毒疫苗试验,但只有极少数的候选艾滋病毒疫苗在这些年龄组中进行了测试。然而,儿童疫苗是疫苗学上最大的成功。Hanke教授和他的同事在非洲新生儿中测试了HIVA疫苗,作为防止通过母乳喂养母婴传播的第一步,并计划使用保守的马赛克疫苗重新访问这些年龄组。









用户评论