科学家建立了新的新生儿糖尿病的新型'Kuma突变体'小鼠模型
糖尿病很少发生在新生儿身上,这种情况被称为新生儿糖尿病。但当它发生时,主要是由于单个基因的突变,如KCNJ11或胰岛素(INS)。这种早发型糖尿病不同于1型糖尿病,它发生在生命的前六个月,可以是短暂的,也可以是永久性的。这种疾病的大部分突变阻止胰腺产生足够的胰岛素,从而导致高血糖水平或高血糖。
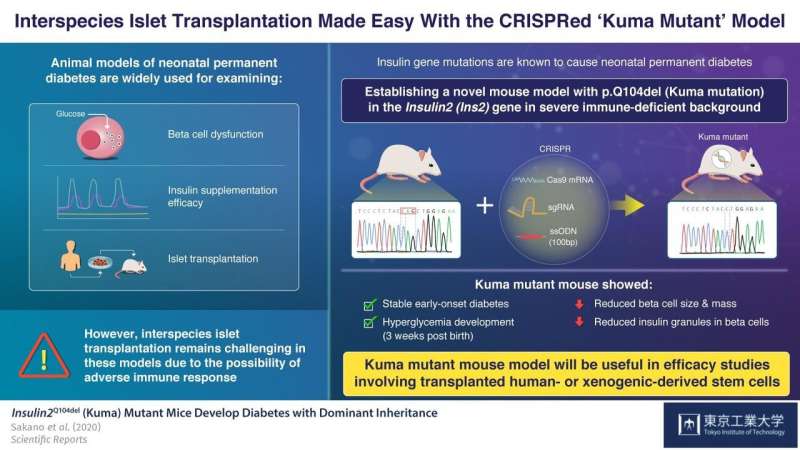
了解造成永久性新生儿的原因糖尿病为了寻找治疗,科学家们经常使用具有胰岛素2(INS2)C96Y基因突变的鼠标和猪模型。这些模型开发了类似新生糖尿病的永久性早期糖尿病。然而,这些模型的主要限制是通过使用它们,物种间移植胰胰岛素的产生细胞(胰岛细胞),称为胰岛移植,不能评估,因为不良的免疫系统反应是这种种间移植的特征。
现在,在一篇发表在科学报告来自东京工业大学的科学家描述了他们如何建立一种新的鼠标模型永久性新生儿糖尿病,其在免疫缺陷背景下表现出严重的胰岛素缺乏和β细胞功能障碍。作为领导这项研究的Shoen Kume教授解释说:“我们想创建一个鼠标模型,使我们能够评估移植人干细胞衍生或异种的疗效胰腺β细胞进入这些小鼠,而不必考虑免疫反应。“
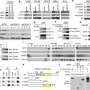
为了实现这一目标,科学家们使用CRISPR/Cas9基因编辑技术,在严重免疫缺陷BRJ小鼠的Ins2基因中引入一个三碱基对缺失,该小鼠缺乏成熟的T和B淋巴细胞以及自然杀伤细胞(NK)。这种突变导致Gln (Q)缺失(p.Q104del),阻碍胰岛素的产生。科学家们将这种突变命名为“隈研吾突变”。
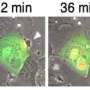
在检查Kuma老鼠时,科学家发现,雄性和雌性Kuma突变体在出生后三周发展高血糖症。他们猜测这可能是由于突变胰岛素蛋白的稳定性低。科学家们还注意到这些小鼠的β细胞面积,大小和质量显着降低,以及β细胞内胰岛素颗粒的数量和大小显着降低。这意味着小鼠可以作为永久性的新生儿糖尿病胰岛移植模型。
为了证实这一点,他们的治疗胰岛素4周后,植入物成功地逆转了他们的高血糖。
基于这些发现,Kume教授和他的团队相信,“Kuma突变体不仅可以用于胰岛素基因和细胞功能障碍的分子研究,而且其免疫缺陷背景使其具有吸引力。模型用于研究从人或异种衍生的干细胞产生的移植β细胞的功能。“
此外,随着Kuma突变在不同物种上保存良好,可以应用相同的基因编辑方法,以在其他动物物种中产生永久性新生儿糖尿病模型,对该疾病的研究进展有点轻松。
进一步探索








用户评论