小脑中蛋白质降解降低导致电动机功能障碍
来自日本熊本大学的研究小组开发了一种动物模型,通过抑制小脑神经元的伴随的伴随伴随的伴侣介导的自噬(CMA)来再现与纺丝大脑共济失调(SCA)中的运动功能障碍和小脑神经变性。由于CMA活性在表达蛋白质的SCA的细胞中减少,因此预计CMA将成为SCA-A疾病的新治疗靶标,目前没有基本治疗。
SCA是由几种基因引起的遗传性顽固性神经疾病。它会导致小脑的萎缩和神经变性,其特征在于渐进式电动机功能障碍,如惊人和脱节(导致控制语音中使用的肌肉丧失的脑障碍)。根据致病基因分为48种不同类型,以及导致的共同机制小脑SCA的萎缩和共济失调尚不清楚。
这细胞生物体具有一种称为自噬的机制,通过分解细胞内成分,这些不必要的蛋白质和消除致病微生物来维持稳态。伴侣介导的自噬(CMA),一种自噬,将细胞内组分传输到溶酶体中,使用HSC70,分子伴侣和灯2a,溶酶体膜蛋白来降解。最近的研究表明,CMA参与了神经元蛋白稳态的维持,降低了CMA活动参与了帕金森氏病的发病CMA与帕金森等神经退行性疾病的关系引起了广泛关注。
熊本大学的研究人员开发了一种评估细胞中CMA活性的原始方法,并研究了其与神经退行性疾病发病机制的关系。在发现表达多种SCA导致蛋白的细胞中观察到CMA活性降低后,他们假设CMA活性降低可能是SCA发病机制的共同部分。
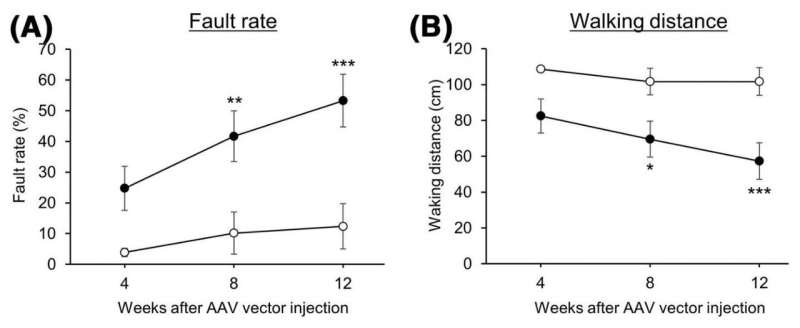
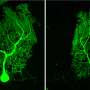
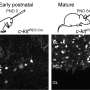
他们通过注射腺相关病毒载体产生了小脑神经元CMA活性降低的小鼠。这些载体能够将一种特异性降低LAMP2A的基因引入小鼠小脑,从而导致进行性运动功能障碍。在运动功能障碍早期,组织学分析显示对小脑神经元形态和小脑结构无影响。然而,神经胶质细胞,如星形胶质细胞和小胶质细胞,在小脑中被激活。神经胶质激活是神经炎症的标志,可导致各种神经退行性疾病的神经退行性变。在一个相当糟糕的阶段电机功能障碍,胶质细胞活化以及小脑神经退行性变及相关小脑皮质萎缩突出。
在小脑神经元CMA活性降低的小鼠中观察到的这些效应(进行性运动缺陷和伴有小脑皮层萎缩的神经退行性变)与SCA患者的观察结果一致。此外,在各种SCA小鼠模型中观察到早期胶质细胞活化。由于CMA活性被发现由负责SCA的蛋白质降低,本研究的结果强烈表明CMA活性降低小脑的神经元是SCA发病机制中常见的分子机制。
“我们已经证明了CMA是一种新的治疗靶点脊髓小脑的共济失调而且可能会导致尚未建立的基本治疗方法的发展,”该研究的负责人、副教授Takahiro Seki说。“对于SCA,致病基因的存在或缺失可以通过基因诊断来确定。然而,即使发现了致病基因,也没有办法预防这种疾病的发生。如果能够开发出一种能够激活CMA的安全化合物,那么它将成为一种非常有效的SCA治疗和预防剂。”
进一步探索








用户评论