基因治疗遗传性失明
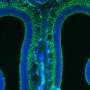
色素性视网膜炎是先天性失明的最普遍的形式。使用色素性视网膜炎小鼠模型,LMU研究人员已经表明目标激活的基因相似的函数可以补偿的主要缺陷。
多达40000人在德国患有色素性视网膜炎。这遗传性疾病特点是视网膜感光细胞的损失,可以在许多不同的突变引起的基因。根据潜在的遗传缺陷的性质,病情的严重程度可以不同夜盲症视野缺损和进步,最终会导致完全失明。第一个基因治疗疾病最近被批准。然而,这些方法有一定的缺点,限制其应用范围。PD埃尔维博士领导的研究小组Becirovic药理学系的自然科学已经开发了一个新的策略博士与教授合作Stylianos Michalakis LMU Opthalmology诊所的医疗中心。这种方法旨在弥补致病遗传缺陷通过激活基因具有类似功能通常被压抑在受影响的组织,并利用CRISPR / Cas9技术的一种变体,在2015年第一次描述了。在在线杂志科学的进步,团队描述的首次成功应用该方法在基因治疗中。
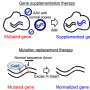
目前,两种策略被用于基因疗法的发展:在基因补充的背景下,试图与一个完整的版本替换有缺陷的基因。然而,这是目前唯一可能相对较小的基因。第二个战略旨在纠正致病突变,但这通常是根据每个突变。针对工作和相关的开发成本高,因此广泛应用这一策略是不可能的。“为了克服这些限制,我们已经开发出一种新的策略,“Becirovic说。
许多基因在人类基因组中属于家庭,其成员实现类似的功能在不同的细胞类型,或被激活在分化过程中不同阶段特定的细胞类型。“我们的想法是补偿功能的突变基因的损失特别激活基因有一个类似的功能,但通常不表达在视网膜细胞”,Becirovic说。“这样做,我们交付的系统称为Cas9-VPR影响视网膜细胞。”
的Cas9-VPR系统是一个导数CRISPR / Cas9技术被广泛用于基因的有针对性的修改。类似于古典CRISPR / Cas9系统,Cas9-VPR利用同一目标原则来指导一个激活蛋白感兴趣的特定基因。
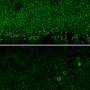
Becirovic和他的同事利用小鼠模型色素性视网膜炎测试激活方法。这些老鼠缺乏感光视紫红质蛋白通常是表示只在视网膜的视杆细胞,昏暗的灯光和夜视所需。研究者Cas9-VPR系统交付到视杆细胞借助一种无害的病毒。通过引入Cas9-VPR棒的老鼠,科学家们开启基因密切相关的视紫红质基因,这通常是活跃在锥负责颜色和日光的愿景。“通过这种方式,我们可以弥补缺乏视紫红质在视杆细胞功能,减弱视网膜变性的速度和改善视网膜功能没有发现副作用,”Becirovic说。
作者相信,一个类似的策略可以应用于广泛的基因和基因疾病,并提供一些显著的优势,超过现有的策略。“鉴于日益增长的重要性基因治疗对患者及其潜在的好处,我们确信,我们的方法将很快被用于最初的临床可行性研究,“Becirovic说。
进一步探索